Dr Marc Lévêque
La stimulation médullaire
La stimulation médullaire est aujourd’hui la technique la plus utilisée dans le traitement chirurgical des douleurs neuropathiques rebelles et, notamment, celles faisant suite à une intervention rachidienne. Pour comprendre l'objectif de geste vous pouvez consulter les pages consacrées à l'anatomie des voies de la douleur. Celles traitant de l'histoire de ces techniques vous éclairerons également sur le principe de ce geste.

Pour ne rien manquer sur l'innovation et les dernières actualités dans le domaine de la stimulation médullaire, vous pouvez me suivre sur LinkedIn
Le Pr Philippe Rigoard, l'un des meilleurs experts internationaux, nous parle de la stimulation médullaire :
Règles et critères d'utilisation
Les différentes phases :
- l'existence d'une douleur chronique rebelle aux traitements médicamenteux
- une discussion multidisciplinaire
- l'implantation de l’électrode et connexion à un boîtier externe de stimulation
- une phase test (7 à 15 jours) pour s’assurer de l’efficacité du dispositif
- l'implantation du neurostimulateur
À qui s’adresse-t-elle?
Dans ses recommandations d’avril 2014, la HAS préconisait la stimulation médullaire pour les patients souffrant de :
- douleur chronique d’origine neuropathique, après échec des alternatives thérapeutiques, secondaires à:
- – un syndrome douloureux chronique radiculaire persistant depuis au moins un an en post-opératoire
- – un syndrome douloureux chronique tronculaire (d’origine diabétique, zostérienne, traumatique ou chirurgicale) persistant depuis au moins un an
- – un syndrome régional douloureux complexe de type I et II persistant depuis au moins six mois.
- douleur d’origine ischémique, en échec des alternatives thérapeutiques secondaires à la maladie de Buerger.
Cette indication devra être posée par une équipe pluridisciplinaire et les objectifs devront être réalistes, en recherchant davantage une amélioration clinique et une diminution du traitement médicamenteux qu’une disparition complète des douleurs.
De quelle technique s’agit-il?
L’électrode sera implantée de manière percutanée (sous anesthésie locale, le patient éveillé) ou bien chirurgicalement (sous anesthésie générale) à la surface de la dure-mére.
L’efficacité pouvant varier d’un patient à l’autre, cette implantation est suivie d’une phase de stimulation test de quelques jours.
Si la diminution de l’intensité douloureuse est d’au moins 50 %, le neurostimulateur sera implanté et connecté à l’électrode puis programmé par le médecin et contrôlé par le patient via une télécommande.
Quelles en sont les contre-indications ?
Le dispositif est contre-indiqué chez les malades avec trouble de la coagulation, infection, atteinte de l’état cognitif ou psychologique.
Les complications les plus fréquentes sont le dysfonctionnement du matériel implanté et le risque infectieux (< 5 %). Les complications entraînant des séquelles neurologiques sont rarissimes. Les examens IRM, par la suite, pourront être contre-indiqués pour certaines parties du corps.
Quel en est le mécanisme d’action?
Il demeure encore mal connu mais l’on peut estimer qu’il repose sur la théorie du «portillon», consistant en un blocage de la transmission du message nociceptif au niveau de la corne dorsale de la moelle épinière par une stimulation en surface de la dure-mére. Cette stimulation produite par l’électrode couvre la douleur par des sensations de paresthésie. Cette thérapie consiste donc à masquer la douleur mais n’en supprime pas la cause.

Ce document sous forme de PDF passe en revue les risques d'interférences avec un dispositif de neurostimulation, il est assez restrictif et plus tout à fait à jour (notamment concernant la nouvelle génération de neurostimulateur compatible avec les IRM sous conditions)

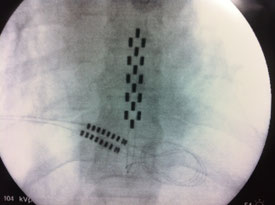
Electrode Chirurgicale

Mise en place d'une électrode de type chirurgicale. Reportage de l'émission "Allo Docteur" avec le Dr Michel Cymes.
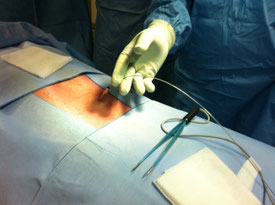
Electrode Per-cutanée
La stimulation médullaire peut-elle me convenir ?
La stimulation de la moelle épinière peut être approprié pour vous si vous répondez aux critères énumérés ci-contre.
Les facteurs médicaux, physiques et psychologiques sont importants et tous les patients potentiels seront à l'évaluation par un médecin spécialiste de la douleur indépendant, un psychiatre ou un psychologue et éventuellement un autre spécialiste selon le type vos douleur. Cela s'appelle l'évaluation pluri-disciplinaire. Tous les patients retenus passeront par une phase de test (voir plus bas) et recevrons une information et une éducation sur la stimulation de la moelle épinière.
Que se passe-t-il avant l'intervention ?
Avant l'implantation une bonne information sur la procédure, les risques et les avantages potentiel de la technique. Il s'agit également d'augmenter la compréhension de la douleur chronique fournir et de travailler sur des objectifs réalistes et de maximiser le bien-être psychologique. Si vous le souhaitez vous pourrez rencontrer d'autres patients ayant eu une expérience similaire. Tout cela doit vous fournir un soutien et vous permettre de donner un consentement libre et éclairer pour la procédure à venir.
Quels sont les étapes ?
Si le chirurgien envisage une électrode percutanée, il est important que vous soyez capable de rester allongé sur le ventre, sur la table d'opération, pendant une à deux heure. Bien que certains patients disent que cela peut leur être difficile, dans la pratique, le niveau de relaxation obtenu par la pré-médication et les anesthésiques locaux très peu de patients rencontrent des difficultés. Il vous sera possible de bouger et de vous tortiller à certains moments et si vous trouvez la procédure pénible, elle peut être stoppée durant quelques minutes.
Il est important que tous les morphiniques aient été arrêtés avant l'opération ce qui peut, parfois, justifier quelques jours d’hospitalisation. Au cours des jours suivant la phase de test (voir plus loin) relativement peu d'antalgiques vous seront fournis afin de nous permettre de déterminer si la stimulation vous est utile ou non dans le soulagement de la douleur.
Dans l'ensemble, ce geste est relativement mineure et n’est pas comparable aux suites d’une intervention rachidienne d’ostéosynthèse par exemple.
La plupart des patients sont en mesure de quitter l'hôpital 24 à 72h après l'implantation à moins que le chirurgien ne préfère effectuer la phase test à l’hôpital. Si après cette phase - d’une semaine à 15 jours - vous êtes soulagé, nous procéderons à l’internalisation du boitier de neurostimulation. On considère, alors, que plus de 80% des patients ont un soulagement satisfaisant de la douleur au bout de trois mois. Après deux années, on considère qu’un patient sur deux demeurent satisfait de ce geste.
Les problèmes techniques, tels que le mouvement de l'électrode, la rupture d'une connexion ou tout autre défaillance du système, peut nécessiter une nouvelle intervention, en général, mineure.
Pourquoi une phase de test ?
Une période de test de la stimulation de la moelle épinière est effectuée avant d'envisager une implantation permanente parce que l'efficacité de la stimulation de la moelle épinière peut varier d'un patient à patient. Cette phase est normalement effectuée en ambulatoire. Après l'implantation de l'électrode, les fils sont ensuite connectés à un programmateur portatif externe qui va permettre de contrôler la stimulation. Dans certaines circonstances nous préférerons effectuer ce test à l'hôpital pendant
même si nous préférons réaliser cette période test de 7 à 15 jours à la maison. Ceci est, en effet, la meilleure façon d'évaluer l'efficacité du stimulateur. Nous pourrons ainsi juger de votre score de douleur selon votre activité, votre utilisation de médicaments et votre rythme de sommeil. Vous reviendrez voir votre neurochirurgien à la fin de l'essai pour l'évaluation. Il est important que vous nous contactiez si vous avez la moindre question ou des problèmes lors de l'essai. Si l'essai venait à échouer nous organiserons la poursuite de la prise en charge avec votre centre de la douleur.

Phase de test avec une électrode chirurgicale pour soulager des douleurs chroniques post-chirurgicales
Qu'advient-il si l'on décide de m'implanter le stimulateur ?
Si la phase test précédente est concluante, vous aurez besoin d'une autre procédure pour l'implantation du neurostimulateur. La première étape de cette procédure sera la fixation ou le remplacement de l'électrode de la phase test. La deuxième étape consistera à implanter la batterie ce qui est effectué sous sédation profonde ou anesthésie générale.
Le placement de la batterie sera discutée avec vous avant la procédure. Une petite incision dans la peau est nécessaire pour placer la batterie soit dans la fesse soit dans l'abdomen. Vous aurez besoin de rester à l'hôpital, normalement une nuit supplémentaire.


Boitier de neurostimulation
A qui la déconseille-t-on ?
La stimulation médullaire vous sera déconseillez si :
- vos douleurs ne relèvent pas de la stimulation médullaire (par exemple en raison d'arthrite ou d'instabilité vertébrale)
- vos douleurs ont une étendue trop importante qu'un système de stimulation de la moelle épinière ne peut couvrir
- vous avez un problème anatomique rendant impossible l'implantation d'une électrode stimulation de la moelle épinière (canal spinal trop étroit) ou l'existence de tissu cicatriciel dans l'espace épidural sur une grande surface
- vous avez une maladie infectieuse active
- vous avez certaines maladies chroniques médicales ou psychiatriques
- vous avez un indice très élevé (ou très faible) masse corporelle
- vous consommez de l'alcool en grande quantité ou drogues récréatives en excès
- vous avez une allergie au nickel ou à d'autres composants du dispositif implantable.
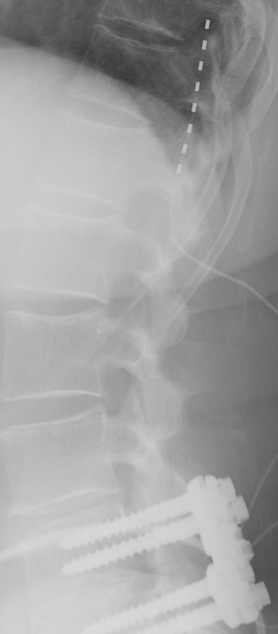
Electrode per-cutanée visant à soulager des douleurs chroniques post-chirurgicales
Pourquoi une phase test dans la stim. médullaire ?
Réfection d'un pansement lors de la phase de test.
Le chargement d'un neurostimulateur Medtronic® de type Intellis®
A quelle douleur s'adresse la stim. médullaire ?
Stimulateur rechargeable ou non rechargeable ?
Quels sont les réglages possibles ?
Procédure de l'électrode percutanée
Quel et le mécanisme de la stim. médullaire ?
Quel suivi après implantation ?
Quel matériel utilise-t-on ?
Reportage (Azur TV) sur la stimulation percutanée
Quelles précautions avec une stim. médullaire ?
Electrode percutanée ou chirurgicale ?
Témoignage - Dr Voirin (Colmar)
Quelle précaution dois-je prendre avec la stimulation médullaire ?
- vous devrez réduire, voir éviter, certaines de vos activités physiques dans les 12 premières semaines suivant le geste d'internalisation.
- si vous nécessitez une intervention chirurgicale vous devrez informer votre chirurgien et votre anesthésiste que vous êtes porteur d'une simulation de la moelle épinière, tout particulièrement si une diathermie est nécessaire (bistouri électrique)
- selon le type d'appareil choisi, l'IRM (Imagerie par résonance magnétique) devra s'effectuer sous certaines conditions mais le plus souvent sera prohibé, le scanner restera possible.
- vous devez savoir que les stimulateurs peuvent activer les portiques d'aéroport et les dispositifs anti-vol des magasins. Ceux-ci, fonctionnent avec des aimants puissants qui peuvent déprogrammer votre stimulateur ou le mettre hors tension.
Combien de temps dure le neuro-stimulateur ?
Cela dépend du type de batterie et combien vous "consommez". En moyenne, une batterie non rechargeable peut durer trois à cinq ans. Le remplacement de la batterie nécessite une procédure simple de chirurgie d'un jour : l'incision précédente est ouverte sous sédation et anesthésie locale et l'on remplace la batterie.
Une batterie rechargeable peut durer plus longtemps, mais doit être changée si elle ne se recharge pas correctement. Le neurochirurgien décidera de la batterie le plus approprié pour vous.
Quelle réglementation ?
La Haute Autorité de Santé (HAS) édicte aujourd'hui des régles de bonnes pratiques et recommande la stimulation de la moelle épinière pour la douleur sévère et prolongée, qui ont répondu à un essai de stimulation dans les douleur chronique d’origine neuropathique, après échec des alternatives thérapeutiques, secondaires à : un syndrome douloureux chronique radiculaire persistant depuis au moins un an en post-opératoire ; un syndrome douloureux chronique tronculaire (d’origine diabétique, zostérienne, traumatique ou chirurgicale) persistant depuis au moins un an ; un syndrome régional douloureux complexe de type I et II persistant depuis au moins six mois. Ainsi qu'au douleur d’origine ischémique, en échec des alternatives thérapeutiques secondaires à la maladie de Buerger. Conformément aux de l'HAS tous les patients sont traités au sein d'une équipe multidisciplinaire qui comprend des médecins, des infirmières et des psychologues. Les patients doivent être aidé à prendre une décision libre et éclairée sur cette indication de stimulation de la moelle épinière et doivent comprendre ce qui leur arrive tout au long de la prise en charge.

Quels sont les risques ou les complications d'une stimulation médullaire ?
- Douleur au niveau du site d'implantation de la batterie. Si cela est grave, une nouvelle intervention chirurgicale ou la suppression du système peut être conseillé.
- Infection (moins de 5 à 100 personnes). Dans ce cas, l'ensemble du système peut nécessité d'être enlevé.
- Saignement pouvant conduire à des ecchymoses et dans de rares cas pouvant nécessiter une nouvelle intervention chirurgicale.
- Maux de tête sévères, qui peuvent nécessiter un traitement par une injection spinale si elle n'est pas améliorer en quelques jours ("Blood patch").
- Les électrodes peuvent se déplacer ou ne pas fonctionner. Cela peut nécessiter une nouvelle opération.
- Stimulation désagréable pouvant ne pas répondre à l'ajustement de la stimulation et, dans certains cas pousser à l'abandon du systéme.
- La stimulation est ressentie à l'extérieur de la zone douloureuse
- Difficulté à couvrir la zone de la douleur, ou à permettre un soulagement suffisant de la douleur pouvant conduire à la révision ou à la suppression du système.
- Réaction allergique conduisant à l'éxèrese du système.
- Diminution du soulagement avec le temps.
- Lésions nerveuses conduisant à des douleurs nerveuses, un engourdissement voir une faiblesse. Cela peut être temporaire ou permanente.
- La paralysie, cela est extrêmement rare moins de de deux patients pour un million
Vos questions sur la stimulation médullaire
Mon neurostimulateur m'expose t'il à la foudre ? (Ludivine)
Non, pas plus que si vous n'en aviez pas
Il y a t'il un risque à utiliser mon vibromasseur avec mon stimulateur ? (anonyme)
Non, pas plus que si vous n'en aviez pas
Cette technique permet elle de soulager la fibromyalgie ? (Marie-France Sauvain dimanche, 22 septembre 2019 19:13)
Non, les douleurs diffuses ne répondent pas à cette technique
Le déplacement d'une électrode chirurgicale médullaire peut-il provoquer des douleurs dans les membres supérieurs ainsi que des maux de tête? (LEROY mardi, 08 octobre 2019 13:03)
Non pour les maux de tête (à moins d'une brèche de dure-mère lors de la mise en place d'électrode)
Peut-on faire des séances d'ostéopathie avec un stimulateur medullaire ? (stephane (vendredi, 13 décembre 2019 18:13)
Il faut éviter les mobilisations du rachis qui pourrait entrainer une traction des câbles, à part cela oui
Peut-on continuer à aller à la piscine avec la stimulation médullaire du fait de l'implantation du matériel ? LEFEBVRE (vendredi, 24 janvier 2020 19:33)
Oui, sans restriction mais seulement après l'implantation définitive et au moins un mois après la dernière chirurgie
Poser votre question, une réponse y sera apportée (sous réserve qu'elle présente un intérêt pour les autres visiteurs) :
Vos commentaire sur la stimulation médullaire
La stimulation par électrode multicolonne dans le traitement de la lombalgie
Une grande étude internationale menée par Philippe Rigoard de Poitiers montre, pour la première fois, l'intérêt de la stimulation médullaire (avec une électrode multicolonne) dans le traitement de FBSS où la #lombalgie chronique prédomine 👏🏻👏🏻👏🏻
Une évaluation économique comparant la stimulation de la moelle épinière et le meilleur traitement médical dans la neuropathie diabétique douloureuse périphériq

Référence
Slangen R, Faber CG, Schaper NC, et al. A trial based economic evaluation comparing spinal cord stimulation with best medical treatment in painful diabetic peripheral neuropathy. J Pain 2016, Dec 16
Introduction
L'objectif économique était de comparer la stimulation de la moelle épinière (SME) en combinaison avec le meilleur traitement médical avec le meilleur traitement médical (MTM) chez des patients souffrant de neuropathie périphérique diabétique douloureuse (NPDD).
Méthode
Un essai contrôlé randomisé prospectif de deux centres, impliquant 36 patients NPDD souffrant de douleur grave des membres inférieurs, ne répondant pas à la thérapie conventionnelle, une évaluation économique a été effectuée. Les ratios coûts-efficacité incrémentiels étaient fondés sur 1) les coûts sociétaux et les années de vie ajustées en fonction de la qualité (QALY) et 2) les coûts directs des soins de santé et le nombre de patients traités avec succès avec un recul de 12 mois.
Résultats et conclusion
À un an le coût total pour la société s'est élevé à 26539 € contre 5313€ par patient respectivement dans le groupe SME et MTM. Les QALYs étaient de 0,58 contre 0,36 et le nombre de patients traités avec succès était de 55% pour la SME contre 7% pour le groupe MTM. Des analyses secondaires ont montré que la rentabilité de SME est devenue plus favorable après correction du déséquilibre des coûts de base entre les deux groupes et surtout après la prolongation de la période d'amortissement du matériel de SME à 4 ans. Bien que la SME soit considérablement plus efficace par rapport au BMT, l'important investissement initial rend la SME non rentable la première année.
Commentaire
Plusieurs études 1,2, notamment la dernière randomisée et prospective, parue dans Pain3 en 2014, ont montré l’efficacité sans équivoque de la stimulation médullaire dans le traitement de la douleur de la neuropathie diabétique. Ce papier, d’une autre équipe hollandaise, vient le confirmer. Curieusement alors que les études médico-économiques précédentes 4-6 évaluant la SME dans le SDRC I et le FBSS montraient que ce dispositif devenait « rentable » après environ 15mois ce travail nous indique que la « rentabilité » dans la NPDD ne pourrait être obtenue qu’après 4 ans. Et encore, cette dernière affirmation relève plus d’une projection et donc d’une hypothèse que d’un fait démontré, la présente étude médico-économique n’a été mené que durant 12 mois.
Comment expliquer cette différence ? Tout d’abord, remarquons que la répartition entre les groupes SME et MTM, n’est pas homogène en particulier concernant l’activité professionnelle : 40% des patients à qui l’on a implanté une SME travaillaient contre seulement 20% dans le groupe MTM. Or l’on sait, d’après les autres études médico-économiques précédentes, que la reprise du travail autorisée par la SME est le facteur qui permet le plus rapidement de « contrebalancer » l’investissement onéreux du dispositif implanté.
Observons, par ailleurs, que contrairement au SDRC I et au FBSS, la NPDD s’intègre dans une pathologie, le diabète, à l’origine de nombreuses comorbidités dont le coût global peut être élevé. Le bénéfice économique de la SME qui n’agit que sur un seul de ces paramètres la NPDD s’en trouve donc « dilué ».
1. de Vos CC, Rajan V, Steenbergen W, van der Aa HE, Buschman HP. Effect and safety of spinal cord stimulation for treatment of chronic pain caused by diabetic neuropathy. Journal of diabetes and its complications. 2009;23(1):40-45.
2. Daousi C, Benbow SJ, MacFarlane IA. Electrical spinal cord stimulation in the long-term treatment of chronic painful diabetic neuropathy. Diabetic medicine : a journal of the British Diabetic Association. 2005;22(4):393-398.
3. de Vos CC, Meier K, Zaalberg PB, et al. Spinal cord stimulation in patients with painful diabetic neuropathy: a multicentre randomised clinical trial. Pain. 2014.
4. Kemler MA, Furnee CA. Economic evaluation of spinal cord stimulation for chronic reflex sympathetic dystrophy. Neurology. 2002;59(8):1203-1209.
5. Taylor RS, Taylor RJ, Van Buyten JP, Buchser E, North R, Bayliss S. The cost effectiveness of spinal cord stimulation in the treatment of pain: a systematic review of the literature. Journal of pain and symptom management. 2004;27(4):370-378.
6. Bala MM, Riemsma RP, Nixon J, Kleijnen J. Systematic review of the (cost-)effectiveness of spinal cord stimulation for people with failed back surgery syndrome. Clin J Pain. 2008;24(9):741-756.
Compatibilité de la stimulation de la moelle épinière et d’un examen par IRM

Référence
Rubino S, Adepoju A, Kumar V, et al. MRI Conditionality in Patients with Spinal Cord Stimulation Devices. Stereotact Funct Neurosurg 2016; 94(4): 254-8.
Introduction
Les examens par IRM sont de plus en plus prescrits et posent régulièrement la question de la compatibilité des dispositifs implantés de stimulation médullaire.
Méthode
Cet article propose une revue de l'expérience clinique avec les différents appareils d'IRM et de stimulation de la moelle épinière. Les auteurs ont examiné la documentation mises à dispositions par les constructeurs et ont réalisé une revue exhaustive de la littérature.
Résultats
L’ensemble des résultats de compatibilités en fonction de la puissance en Tesla de l’IRM, du type de neurostimulateur et d’électrode et de la localisation de l’implantation de ces matériels figure dans deux tableaux
Discussion et conclusion
Cette revue de la littérature et des notices des fabricants de stimulateur met à disposition des praticiens un document auquel ils peuvent se rapporter en cas de doute.
Commentaire
Auparavant les choses étaient simples : un porteur de stimulateur ne pouvait plus bénéficier d’une IRM.
Le lancement de nouveaux dispositifs (neurostimulateur et électrode) par les trois acteurs du marché (Medtronic, St Jude Medical, Boston Medical) va compliquer de plus en plus la donne ! Cet article (heureusement gratuit et en libre accès !) à l’adresse https://www.karger.com/Article/Pdf/448764 avec ses tableaux récapitulatif est donc un document précieux pour tous les praticiens - qu’ils soient radiologues ou algologues - en charges de ces patients.
Efficacité de la stimulation de la moelle épinière dans le traitement adjuvant de l'angine de poitrine réfractaire

Efficacité de la stimulation de la moelle épinière dans le traitement adjuvant de l'angine de poitrine réfractaire
Référence
Imran TF, Malapero R, Qavi AH, et al. Efficacy of spinal cord stimulation as an adjunct therapy for chronic refractory angina pectoris. International journal of cardiology 2017; 227: 535-42.
Introduction
Les patients souffrant d'angine réfractaire chronique dont les symptômes ne sont pas contrôlés par des traitements conventionnels ont une mauvaise qualité de vie. Des traitements complémentaires, comme la stimulation de la moelle épinière (SME) peuvent être envisagés. Cette étude visait à déterminer si la SME était associée à des changements dans la capacité d'exercice et à dans la sévérité de l'angine de poitrine chez ces patients.
Méthode
Une méta-analyse de la littérature via Pubmed, Medline et d'autres bases de données a été effectuée jusqu'en décembre 2015. Deux examinateurs ont extrait les données indépendamment et évalués les risques de biais. La capacité d'exercice comprenait la durée d'exercice et le produit de pression de débit, déterminée par un test d'effort. La gravité de l'angine comprenait la fréquence quotidienne de l'angine et la consommation de nitrate.
Résultats
Un total de 518 participants (1048,25 années-personnes de suivi), provenant de 14 études ont répondu aux critères d'inclusion. L'âge moyen était de 66,8 ans avec 68,5% d'hommes. La durée de l'implant SCS variait de 3 semaines à 5 ans (médiane: 6 mois). En utilisant la méta-analyse des effets aléatoires, nous avons observé que la SME était associée à une durée d'exercice plus élevée (1,90 min, IC 95% 1,71, 2,06), un angor de gravité inférieure, 1,55 moins d'angine de poitrine quotidienne (IC 95% -1,75, -1,33) , 1,54 moins de nitrates quotidiens consommés, (IC 95% -1,81, -1,26) et un score SF-36 de 22 points plus élevé (IC 95%: 10,76, 32,81, pb 0,0001).
Conclusion
Cette méta-analyse suggère que la SME, en tant que traitement adjuvant de la prise en charge médicale, est associée à une plus longue durée d'exercice et à une diminution de la fréquence des angors et de la consommation de nitrate chez les patients atteints d'angine de poitrine réfractaire chronique qui ne sont pas candidats à un geste percutanée ou de revascularisation
La stimulation médullaire : une nouvelle thérapie dans le syndrome des jambes sans repos ?

La référence
L'article
Ce cas rapporté nous présente un patient dont le syndrome des jambes sans repos (SJSR) a été guéri par une stimulation de la moelle épinière (SME) dans le cadre du traitement de douleur neuropathique (DN) chronique.
Il s’agit d’un patient souffrant de DN irréductibles et d’un SJSR ayant bénéficié d’une SME après une phase test positive. Le patient a été interrogé en détail sur ses symptômes de SJSR immédiatement avant l’internalisation puis à 6 semaines, 6 mois, et 2,5 ans de cette procédure. Le patient a également répondu au questionnaire de l’échelle internationale de SJSR afin de quantifier objectivement la gravité de ses symptômes. Le patient a signalé une nette amélioration symptomatique de ses symptômes du SJSR avec amélioration de la qualité et de la quantité de sommeil en plus de ses douleurs. Le score du patient, sur les jambes sans repos international Syndrome Scale est passé après l'implantation de 33 à 0 sur une échelle de 40 points. En outre, lorsqu'on il lui a été demandé de tenir un registre d’utilisation de son stimulateur, le patient a précisé qu'il l’utilisait surtout avant d'aller au lit pour atténuer ses symptômes du SJSR et n'avait, ainsi, plus besoin de médication.
La stimulation épidurale pourrait constituer un supplément, une alternative ou une nouvelle thérapie dans le traitement du SJSR.
Le commentaire
Nous avons retenu cette publication, même si elle ne concerne pas directement la douleur, car les neurologues savent que le syndrome des jambes sans repos engendre une souffrance importante et les traitements en sont décevants. Il convient, bien entendu, d’être prudent devant ce premier cas rapporté mais il est intéressant que nos lecteurs aient cette notion à l’esprit s’ils venaient à être confrontés à un patient souffrant à la fois DN et de SJSR.
On peut concevoir que la stimulation de la moelle péridurale diminue le tonus sympathique du système vasculaire périphérique provoquant ainsi une relaxation des muscles et une vasodilatation provoquant par l’augmentation du débit sanguin une diminution de l'hypoxie tissulaire distale permettant, par ce biais, une amélioration des symptômes du SJSR. Une action cérébrale ¾ comme dans les douleurs neuropathiques ¾ n’est pas, non plus, à exclure.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
L'évaluation psychologique pré-chirurgicale et corrélation avec l'efficacité de la stimulation médullaire dans la réduction de la douleur chronique

La référence
L'article
Certaines études ont montré l’importance du dépistage psychologique des candidats à la stimulation de la moelle épinière (SME) dans le traitement de la douleur, néanmoins, aucun consensus existe. Cette étude s’est donné pour objectif de revoir l’évaluation psychologique (par exemple, Millon Behavioral Medicine Diagnostic), les croyances concernant l'efficacité de la SME, la douleur autodéclarée et la qualité de vie (QOL) chez les patients ayant été approuvés pour la SME.
Les candidats potentiels à une SME ont été contactés 3 à 7 ans après leurs évaluations médico-psychologiques, parmi eux 59 ont consenti à une entrevue téléphonique structurée. Trente-quatre de ces 59 avaient bénéficié d’une SME. Parmi ces 34 patients implantés, 22 ont été approuvés par une évaluation psychologique de routine tandis que 12 ont fait l’objet d’une évaluation psychologique approfondie.
La majorité des répondants ¾ 62% ¾ ont signalé une réduction efficace de la douleur et 64% de ces bénéficiaires d’une SME ont signalé une amélioration de leur qualité de vie. Les patients les plus jeunes ont rapporté des scores plus élevés de la douleur préimplantatoire, et les participants avec des niveaux les plus élevés de douleur préimplantatoire déclaraient plus volontiers qu'ils subiraient à nouveau la procédure. Les malades ayant déclaré des problèmes d'alcool préopératoires étaient plus enclins à déclarer des niveaux inférieurs de douleurs postopératoires.
Des attentes préopératoires raisonnables vis-à-vis de la SME, une bonne intégration psychosociale et une compréhension satisfaisante par le patient de ses douleurs sont des facteurs psychologiques prédictifs d’une diminution de l’intensité de la douleur et de l’amélioration de la qualité de vie.
Le commentaire
Sur les 200 patients ayant bénéficié d’une évaluation psychologique en vue d’une SME dans cet hôpital texan seulement 59 ont pu être contacté ¾ soit moins de 30% ¾ et parmi eux 23 uniquement ont fait l’objet d’une évaluation psychologique approfondie.
Des résultats qui sont donc à interpréter avec prudence même s’ils sont conformes à ce que nous savions déjà. Par ailleurs, on regrette que ces auteurs américains n’aient pas répertorié certaines données telle la notion d’antécédent d’accident du travail (AT).
Il aurait été intéressant de savoir si les différences de législation sociales concernant l’AT pouvaient, par exemple, atténuer ce critère considéré comme péjoratif dans notre pays.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
La stimulation médullaire atténue la sommation temporelle chez les patients souffrant de douleurs neuropathiques

La référence
L'article
Il a été démontré que la stimulation électrique des cordons postérieurs atténue les phénomènes de "wind-up"[1] au niveau des neurones de la corne dorsale des rats dont les racines nerveuses ont été lésées. L’objectif de cette étude était de tester l'effet de la stimulation de la moelle épinière (SME) sur la sommation temporelle (ST) — le corrélat clinique de ce phénomène électrophysiologique de "wind-up" — chez les patients souffrant de douleurs radiculaire du membre inférieur.
Dix-huit patients avec SME ont été testés trente minutes après l'activation de la SME ("ON") puis deux heures après l’inactivation ("OFF"), cela dans un ordre aléatoire. La ST a été évaluée dans le site le plus douloureux du membre inférieur touché ainsi que dans la région anatomique correspondante du membre controlatérale grâce à l’application d'un stimulus thermoalgésique (46,5°C - 120 secondes). Les patients devaient signaler l’intensité de cette douleur sur une échelle numérique (0-100) lors des phases "ON" et "OFF". Le test de Wilcoxon a été utilisé pour comparer ces phases "ON" et "OFF".
La SME diminue significativement l’intensité douloureuse (de 66 ±18 à 27 ±31, P< 0,001). Dans le membre indemne, la SME n’a pas d’effet sur la ST (24 ±20 durant la phase "OFF" contre 21 ±24 lors de la phase "ON", P=0,277) en revanche, une diminution significative de la ST a été observée dans le membre lésé après SME (32 ±33 à 19 ±24, P =0,017).
Ces résultats suggèrent que l'atténuation de la ST — ce qui correspond à une atténuation de l'hyperexcitabilité des neurones de la moelle épinière — est un mécanisme possible de l’efficacité de la SME chez les patients souffrant de douleurs neuropathiques.
Le commentaire
Outre son faible effectif, on pourra également reprocher à ce travail — il en est souvent question lorsqu’il s’agit de SME — l’absence d’évaluation à l’aveugle du fait des paresthésies provoquées par la stimulation. Une faiblesse méthodologique à laquelle la stimulation haute fréquence devrait pallier. Ce travail israélien portant sur la SME et la modulation endogène de la douleur devrait nous permettre — comme le soulignait l’éditorial de Pain[2] — d’établir de meilleurs critères de sélection des patients.
Bibliographie
[1] Le « wind-up » correspond au recrutement à haute fréquence des fibres C qui produit une augmentation du nombre de potentiels d’actions des fibres de la moelle. Le « wind-up » est un phénomène passager de relativement courte durée, mais le recrutement répété des fibres C peut aussi conduire à une sensibilisation spinale dont la durée pourra s’étendre sur plusieurs heures ou même plusieurs jours
[2] Voir l’une de nos précédentes revue de presse : http://infodouleurneuromodulation.com/revue-de-presse/stimulation-de-la-moelle-épinière-la-nécessité-d’en-préciser-les-mécanismes
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
Comparaison entre la stimulation médullaire à haute fréquence et la stimulation conventionnelle

La référence
L'article
Cette étude vise à comparer la réponse thérapeutique des patients traités par une stimulation de la moelle épinière conventionnelle et ceux stimuler à haute fréquence.
Douze patients qui souffraient de douleurs neuropathiques au dos et à la jambe et qui répondaient aux critères cliniques standard la SME classique, c’est-à-dire à basse fréquence, ont participé à une séance d'une demi-journée de stimulation à haute fréquence (SHF) au cours de la période test. Cette SHF variait de 50 Hz à 4 kHz ou de 100 Hz à 10 kHz avec des réglages de tension de 0,5 V à 10 V. La douleur a été évaluée sur le score visuel de 0 à 10.
Deux des 12 patients n’ont pas bénéficié des effets de la SME tant par SBF ou SHF. Chez les 10 patients restants, les paresthésies ont été significativement atténuées par la SHF, et pour 4 les paresthésies ont pu être totalement éliminées. Cinq patients ont préféré la SHF à la SBF tandis que trois autres ne mentionnaient pas de différence. Des sensations brusques au début de HFS ont été décrites chez 6 patients. Chez 10 patients la SHF a pu être portée à la tension maximale de 10 V sans gêne. Les 4 patients pour qui la phase test n’a pas été concluante avaient une histoire douloureuse significativement plus longue que les huit patients ayant bénéficié d’une implantation (11,2 vs 4,3 ans, [p : 0,04]).
La SHF modifie de manière significative les sensations de paresthésies dans la majorité des patients (dix de 12) et a été préféré à la SBF pour 5 des 12 patients et non inférieure à la SBF chez 8 des 12 patients que ce soit à 4 kHz que 10 kHz. La SHF autorise des voltages élevés sans l’inconfort de paresthésies désagréables.
Le commentaire
Certains papiers1-3 avaient déjà montrés la meilleure tolérance de la stimulation haute fréquence mais sur des effectifs plus importants et sur une durée supérieure à une demi-journée comme c’est le cas dans cette étude portant seulement sur une douzaine de patients...
Il dommage également que l’effet sur les lombalgies n’ai pas été investigué puisque des études 2,3 laissent penser l’effet de la SHF serait intéressant. On déplorera, enfin, que les auteurs ne précisent pas, dans cette série, s’il s’agit d’électrodes chirurgicales ou percutanées
Bibliographie
1. Al-Kaisy A, Van Buyten JP, Smet I, Palmisani S, Pang D, Smith T. Sustained effectiveness of 10 kHz high-frequency spinal cord stimulation for patients with chronic, low back pain: 24-month results of a prospective multicenter study. Pain Med. 2014;15(3):347-354.
2. Tiede J, Brown L, Gekht G, Vallejo R, Yearwood T, Morgan D. Novel spinal cord stimulation parameters in patients with predominant back pain. Neuromodulation : journal of the International Neuromodulation Society. 2013;16(4):370-375.
3. Kapural L, Yu C, Doust MW, et al. Novel 10-kHz High-frequency Therapy (HF10 Therapy) Is Superior to Traditional Low-frequency Spinal Cord Stimulation for the Treatment of Chronic Back and Leg Pain: The SENZA-RCT Randomized Controlled Trial. Anesthesiology. 2015;123(4):851-860.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
La fréquence de la prescription d'IRM chez les patients porteurs de stimulation médullaire

Référence
Desai MJ, Hargens LM, Breitenfeldt MD, et al. The Rate of Magnetic Resonance (MR) Imaging in Patients with Spinal Cord Stimulation (SCS). Spine. 2015.
L'article
L’Imagerie par Résonance Magnétique (IRM) est l’examen complémentaire le plus fréquemment prescrit pour évaluer les douleurs rachidiennes. Cette imagerie est généralement contre-indiquée chez les patients porteurs d’une stimulation médullaire externe (SME) en raison des risques liés aux interactions du champ magnétique avec le matériel implanté. L’objectif de cette étude est d’évaluer la proportion de patients susceptible de bénéficier d’une IRM dans les cinq ans suivant l’implantation.
Afin d’évaluer le pourcentage de patients porteurs de SME et pouvant bénéficier d’IRM une estimation a été faite en appariant une cohorte de patients non-implantés tirée des données de quatre années de l’assurance-maladie.
Environ 82 à 84% des patients porteurs d’une SME devraient avoir besoin d'au moins une IRM dans les cinq ans suivant l’implantation. En outre, 59 à 74% des patients nécessiteront d’une IRM non rachidienne dans les 10 ans.
Le besoin d’un examen IRM chez les patients porteurs de SME paraît important. Cette analyse met en évidence la nécessité d’un dispositif de SME compatible à l’IRM afin de permettre à ces patients cette modalité d'imagerie.
Le commentaire
Cette étude a le mérite de confirmer une idée largement partagée par les praticiens et l’industrie : la nécessité d’un dispositif de SME compatible à l’IRM. Si l’on considère la part grandissante de l’IRM en radiologie il y a fort à penser que les résultats de cette enquête rétrospective seront en deçà de la réalité dans les années à venir aux États-Unis. Précisons à ce sujet, et c’est une des limites à ce travail, que ces données proviennent d’assurances maladies américaines et, à ce titre, ne peuvent être extrapolées en France.
Rappelons qu’aujourd’hui il existe des boîtiers de neurostimulation et des électrodes percutanées de SME compatibles à l’IRM. Outre qu’elles ne constituent plus une contre-indication, ces électrodes percutanées compatibles à l’IRM (SureScan ® - Medtronic ®) présentent également l’avantage de ne pas générer d’artefact. Pour l’heure, il n’existe pas encore d’électrode chirurgicale compatible à l’IRM.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
Efficacité de la stimulation médullaire dans la douleur chronique : une revue systématique

La référence
Grider JS, Manchikanti L, Carayannopoulos A, Sharma ML, Balog CC, Harned ME, et al. Effectiveness of Spinal Cord Stimulation in Chronic Spinal Pain: A Systematic Review. Pain physician, 2016, 19: E33-54
L'article
Les douleurs neuropathiques représentent une part importante des douleurs chroniques dans le monde, parmi elles les douleurs rachidiennes du syndrome d’échec de la chirurgie du rachis (FBSS) génèrent des dépenses considérables des systèmes de santé.
L’objectif était d’évaluer le rôle et l'efficacité de la stimulation de la moelle épinière (SME) dans la douleur rachidienne chronique au travers d’une revue systématique des essais contrôlés randomisés (ECR) de SME dans la douleur rachidienne chronique. La littérature disponible sur la SME a été passée en revue selon les critères d'évaluation de la qualité de Cochrane en veillant à évaluer les risques de biais. Les niveaux de preuve ont été classés de I à V. Les sources de données proviennent des articles publiés de 1966 à Mars 2015 identifiés grâce à des recherches menées dans PubMed et EMBASE. Seuls les ECR avec un suivi minimum de 12 mois ont été considérés pour la SME classique. Pour les études portant sur la stimulation adaptative, haute fréquence (HF) ou par bouffées « Burst », des temps plus courts ont été considérés.
Six ECR ont été considérés. Le niveau de preuve d’efficacité de la SME dans les FBSS est élevé : de niveau I à II. En revanche le niveau preuve de la stimulation à haute fréquence ¾ sur la base d’une ECR de haute qualité ¾ est de II à III. L’absence d'étude de bonne qualité concernant la stimulation par « Burst » ou adaptative rend l’évaluation de l’efficacité difficile.
Le commentaire
Des soixante-trois études ayant été étudié, six seulement satisfont aux exigeants critères Cochrane. A chaque fois que ces critères méthodologiques étaient réunis, l’efficacité de la SME « classique » était avérée dans le traitement des douleurs neuropathiques du FBSS. Pour les nouvelles modalités de stimulations (HF, adaptative et Burst) l’efficacité peine à être démontré en raison de leurs faibles effectifs. On regrette que cette revue de la littérature n’est pas tenté de caractériser les patients répondant à la SME.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
L'effet de la stimulation médullaire sur le sommeil

La référence
L'article
Les études sur la douleur chronique montrent que les troubles du sommeil surviennent chez 50 à 88% des patients et, toutes, montrent qu’une diminution des douleurs se traduit par une amélioration du sommeil. Jusqu’à présent l’impact de la stimulation de la moelle épinière (SME) sur le sommeil n’a pas été étudié.
L'impact de la SME sur la qualité du sommeil a été évalué de façon prospective en utilisant l'Indice de gravité de l'insomnie (ISI) et l’Echelle de somnolence d’Epworth (ESS). En outre, les corrélations entre sommeil et douleur ont été évaluées. Après implantation de la SME, les patients ont du compléter six questionnaires validés afin de comparer leur habitudes de sommeil, l'intensité de la douleur et la qualité de vie au moment de l’implantation et six mois après. Ces résultats ont été analysés par l'intermédiaire d'échantillons appariés, de t-tests et d’analyses bi-variées.
Les données de 27 patients ont été recueillies. Une diminution significative des scores ISI a été observés (n = 23, t [df] = 2,9 [22], p = 0,008) ainsi qu’une tendance à l'amélioration en pourcentage entre l'ISI et ESS (n = 12, t [df] = 2,0 [10], p = 0,078). Il n’a pas été observé d'amélioration significative de l’ESS. Une régression de l'insomnie a pu être corrélée à une d'intensité de la douleur mesurée sur l’échelle visuelle analogique et le questionnaire de douleur de McGill (R = 0,546, p = 0,007 et R = 0,559, p = 0,006, respectivement).
La SME permet une régression des scores d’insomnie à six mois, de plus, on constate une corrélation entre la diminution de l’intensité de la douleur chronique et l’ISI
Le commentaire
Que la diminution de la douleur par SME s’accompagne d’une amélioration du sommeil cela semblait, intuitivement, aller de soi. On pouvait, néanmoins, se demander si le sevrage en postopératoire de médicaments ¾ antiépileptiques et/ou antidépresseurs ¾ connus pour abaisser la vigilance ne pouvait pas induire un rebond d’insomnie. Il est dommage, à ce titre, que les auteurs ne nous fournissent aucune donnée sur cette prise médicamenteuse pré et post-opératoire. On regrettera, également, la population restreinte de cette étude. Une étude qui, tout de même, a le mérite de prouver ce que l’on devinait ou observait.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
Les conséquences des délais d'attente sur le succès de la stimulation médullaire

La référence
Kumar K, Rizvi S, Nguyen R, Abbas M, Bishop S, Murthy V. Impact of Wait times on Spinal Cord Stimulation Therapy Outcomes. Pain Pract. 2013 Oct 25.
L'article
Actuellement, le taux de réussite à long terme de la stimulation de la moelle épinière (SME) varie entre 47 et 74%. Son efficacité semble inversement proportionnelle au temps écoulé entre l'apparition de la douleur chronique et l'implantation. Pour améliorer les résultats, cette implantation gagnerait à être effectuée tôt. Cette étude identifie les sources de retard et offre des suggestions d'amélioration.
Une analyse rétrospective a été menée chez 437 patients traités par SME afin d’identifier les retards entre le diagnostic du syndrome douloureux et l'implantation. Une analyse de variance a été effectuée sur les effets de l'âge, du sexe, des traitements précédents sur le retard d'implantation. Un modèle de régression linéaire multiple a été élaboré afin d’évaluer les facteurs qui contribuent à retarder l'implantation.
Entre le diagnostic du tableau de douleur chronique et l'implantation les patients ont attendu 65,4 ±2,04 mois. Le premier contact avec le médecin a eu lieu 3,4 ±0,12 mois après le développement du tableau. Les médecins de famille ont pris en charge les patients durant 11,9 ±0,45 mois tandis que les spécialistes sont intervenus durant une période supplémentaire de 39,8 ±1,22 mois. Les neurochirurgiens ont été les plus réactifs pour adresser à un praticien implanteur (32,28 ±2,64 mois), tandis que les orthopédistes et les anesthésistes contribuaient à des temps d'attente respectifs de 51,60 ±5,04 mois et 58,08 ±5,76 mois. Une fois la décision d'implantation prise 3,31 ±0,09 mois supplémentaire ont été nécessaire pour organiser la procédure. Une diminution progressive du temps d'attente a été observée de 1980 à aujourd’hui.
Afin d’améliorer les taux de réussite de la SME, il semble recommander d’adresser au plus vite les patients à un médecin implanteur dès lors que le caractère rebelle de la douleur a pu être démontré.
Le commentaire
Curieusement — et en dépit de ce que nous en promet le titre — cette publication vise avant tout à identifier, dans le parcours de soin, les étapes qui retardent l’implantation de la SME. Si l’on s’en tient à ce que nous annonce le titre « l’impact de l’attente sur les résultats de la SME » on ne trouvera, hélas, pas la réponse dans cet article mais dans un autre papier1, du même auteur.
Dans cette étude de 2007, mené sur 424 patients, Kumar établit un lien hautement significatif et inversement proportionnel entre le taux de succès et le délai d’implantation (Figure 1).
Ainsi on observe que le taux de succès sera proche de 85% pour un délai inférieur à 2 ans contre 8% après plus de quinze ans d’attente.
On regrette dans la présente étude — outre son caractère rétrospectif — que les auteurs se soient bornés à identifier la nature du retard seulement en fonction des spécialistes consultés.
Il aurait été, également, intéressant d’étudier l’historique des médications (leurs durées, associations et posologies) afin d’observer la différence d’appréciation dans la notion d’« échec du traitement médicamenteux ».
La bibliographie
1. Kumar K, Wilson JR. Factors affecting spinal cord stimulation outcome in chronic benign pain with suggestions to improve success rate. Acta neurochirurgica. Supplement. 2007;97(Pt 1):91-99.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
La stimulation médullaire haute fréquence est supérieure à la stimulation traditionnelle dans le traitement des lombalgies et des radiculalgies chroniques

La référence
L'article
Les traitements médicamenteux des douleurs chroniques peuvent avoir une efficacité limitée souvent des effets indésirables, cela encourage d’autres approches thérapeutiques et en particulier la stimulation de la moelle épinière (SME). La SME délivrée à une haute fréquence à 10 kHz (HF10) permet un soulagement de la douleur sans l’inconvénient des paresthésies typiques de la SME traditionnelle à basse fréquence.
L'objectif de cette étude randomisée a été de comparer la sécurité et l'efficacité des thérapies par SME HF10 chez les patients souffrant de douleurs de dos et des jambes. Un total de 198 sujets souffrant à la fois de lombalgies et de radiculalgies ont été randomisés selon un rapport 1:1 dans 10 centres de traitement de la douleur. Parmi ceux-ci, 171 sont passés par une phase test pour ensuite être implantés avec un système de SME.
Les répondeurs — résultat primaire — ont été définis comme ayant 50% de réduction des douleurs sans déficit neurologique liées à cette stimulation. A 3 mois, 84,5% des sujets du groupe HF10 ont vu leurs lombalgies diminuer et 83,1% des radiculalgies des membres inférieurs contre respectivement 43,8% et 55,5% dans le groupe SME traditionnel (P <0,001). Le ratio relatif était de 1,9 (IC 95%, 1,4 à 2,5) pour lombalgie et de 1,5 (IC 95%, 1,2 à 1,9) les radiculalgies. La supériorité de la HF10 sur la SME pour la jambe et le mal de dos a été observée durant 12 mois (p <0,001).
Les patients traités par HF10 ne connaissent pas paresthésie. La thérapie par HF10 influe donc favorablement sur la gestion des radiculalgies et des lombalgies et ouvre de perspectives prometteuses.
Le commentaire
Cette étude d’une remarquable qualité méthodologique parue dans la revue Anesthesiology de ce mois-ci plaide en faveur de la SME dans le traitement des douleurs chroniques et, tout particulièrement au recours à la haute fréquence. Les taux d’efficacité sont inférieurs à ceux que l’on rencontre habituellement dans la littérature pour la SME « classique » et peuvent être du, à l’utilisation d’électrodes percutanées.
Le recours à des électrodes chirurgicales multicolonnes auraient probablement livré de meilleurs résultats, notamment dans la composante lombaire des douleurs. Le délai tardif d’implantation — 13,6 ans en moyenne après que le diagnostic de douleur chronique était posé — est également une explication à ces résultats plutôt inférieurs à ceux que nous connaissons. Une stimulation haute fréquence avec des électrodes multi-colonnes pourraient augurer de résultats supérieurs.
Cette étude méritera d’être complété par une étude médico-économiques dans la mesure où la stimulation haute fréquence est gourmande en énergie — plus encore lorsqu’il s’agit d’électrode percutanée — et, de ce fait, implique le recours systématique à des dispositifs rechargeables que l’on sait beaucoup plus onéreux.
Dr Marc Lévêque
Une information plus exhaustive est disponible sur le site d'Actudouleurs auquel l'auteur contribue régulièrement
Le monitoring multimodal lors du positionnement d'une électrode chirugicale de stimulation médullaire au niveau cervico-thoracique

La référence
L'article
Des potentiels évoqués somatosensoriels (PES) et moteurs (PEM) ainsi qu’une surveillance électromyographique (EMG) ont été réalisés lors de la mise en place, sous anesthésie générale, d’une électrode chirurgicale par laminectomie cervicale ou thoracique lors d’une étude rétrospective portant sur 25 patients.
Les PEM et les PES ont été utilisés pour la surveillance de la moelle épinière lors de la pose. Les amplitudes des PES et les seuil des potentiels d'action musculaire (PAM) au niveau des extrémités supérieures et inférieures ont été enregistrés afin de déterminer la latéralité de l’électrode.
Une diminution significative de l'amplitude des PEM stable, en dépit de PES stables, a été observée chez deux patients : l’un avec une insertion rétrograde C1-C2 et le second lors d’une insertion antérograde C4-C5 insertion. Un repositionnement basé sur des tests montrant une asymétrie des PES (6 patients) et des seuils de PAM (8 patients) a été nécessaire. Chez 22 patients, la couverture des paresthésies au niveau de la zone était satisfaisante de façon uni ou bilatérale. Il n'y a eu aucun épisode de révision d’électrode en raison d’un mauvais placement.
La neurophysiologie peropératoire reposant sur les PEM et les PES peu s’avérer utile pour un placement en toute sécurité et optimal des électrodes de stimulation médullaire au niveau cervico-thoracique.
Le commentaire
L’idée de cette étude réalisée par une équipe coréenne n’est pas nouvelle. Quatre papiers ont déjà été publiés tentant de montrer l’apport de l’électrophysiologie lors du placement d’une électrode chirurgicale1-4 , toute avait un nombre supérieur de patients à celle-ci, entre 44 et 259 patients. Les conclusions étaient équivalentes, l’électrophysiologie confirme que le positionnement de l’électrode est bien médial.
En revanche, toutes ces études s’accordent à montrer que les PES, les PEM ou les deux peinent à vérifier l’exactitude du niveau d’implantation. Ce qui est dommage. En effet dans la pratique, et c’est de plus en plus le cas avec les électrodes multicolonnes, l’imagerie par fluoroscopie antéro-postérieure — voir l’O-arm® — nous permettent de vérifier que l’électrode est bien médiane. Le niveau médullaire de la couverture, malgré les moyens d’explorations anatomiques dont on dispose (IRM pré-opératoire permettant de confirmer le niveau du cône et imagerie peropératoire), demeure plus problématique. Le second argument de cette équipe coréenne qui plaiderait pour l’utilisation de l’électrophysiologie est de renforcer la sécurité de la pose. Il n’est pas certain, là non plus, que le « jeu en vaille la chandelle ». On sait que les lésions médullaires sont rares dans la pose d’électrode chirurgicale (0,54%) et, lorsqu’elles surviennent, c’est généralement lié à un hématome épidural qui se forme en post-opératoire.
Plutôt qu’à titre systématique — nous venons d’en voir les limites — l’électrophysiologie peropératoire pourrait s’avérer utile en cas de canal rachidien étroit visible sur le CT ou l’IRM et notamment lors du recours à une électrode multicolonne que l’on sait plus volumineuse.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
La stimulation médullaire : les mécanismes sous-tendant le traitement de la douleur neuropathique

Référence
Marchand S. Spinal Cord Stimulation (SCS) Analgesia: Substantiating the Mechanisms for Neuropathic Pain Treatment. Pain. 2015
Ce mois-ci, dans PAIN, un article a retenu notre attention. Il s’agit d’un long commentaire de Serge Marchand à propos d’une étude dont nous nous ferons prochainement l’écho. Ce commentaire a valeur d’Éditorial tant il cerne avec pertinence les problématiques auxquelles la stimulation médullaire est aujourd’hui confrontée. Le chercheur canadien considère qu’une meilleure compréhension des mécanismes de la SME — tant au niveau spinal que des centres supérieurs — devrait déboucher, à terme, sur une meilleure sélection des indications de SME.
L'article et le commentaire
Le recours à la stimulation électrique du système nerveux périphérique dans le traitement de la douleur est très ancien et remonte à l’utilisation des anguilles électriques il y a plusieurs milliers d'années 1. Notre compréhension moderne des mécanismes de la stimulation électrique dans le soulagement de la douleur débute avec la théorie du portillon selon laquelle la stimulation sélective des afférences non-nociceptive (Aß) inhibe les afférences nociceptives (A∂ et C) par l'activation des interneurones inhibiteurs de la substance gélatineuse des cornes postérieures de la moelle épinière 2. La stimulation nerveuse électrique transcutanée (TENS) a été développée pour déclencher cette analgésie endogène par une stimulation périphérique. Le développement de la stimulation de la moelle épinière (SME) découle du même mécanisme 3 et consiste en l'implantation d’une l'électrode épidural en regard des cordons postérieurs au niveau spinal du dermatome sur lequel l'effet analgésique est recherché. Ce mécanisme de la SME — basé sur le même postulat neurophysiologique que le TENS — est néanmoins plus complexe, car cette stimulation appliquée sur les cordons postérieures recrute d’autres afférences de la moelle épinière vers les centres supérieurs, implique des circuits de neurones locaux et même des fibres des cornes antérieures 4. Cette stimulation de la moelle épinière a été utilisée dans différents types de douleur avec un peu plus de 50% des patients soulagés d’au moins 50% de leurs douleurs 5. Ces résultats doivent néanmoins être replacés dans leur contexte puisque, habituellement, il s’agit d’une thérapie de dernier recours lorsque tous les traitements conventionnels ont échoué. La sélection des patients demeure déterminante dans le succès de la SME 5,6 . Cependant, même si l’on cerne précisément un grand nombre de facteurs tels la localisation de la douleur, son type, son intensité, sa durée, les antécédents chirurgicaux, les éventuels bénéfices secondaires, l'âge, le sexe, la durée de ce suivi, le type d’électrodes, tous les résultats montrent, presque toujours, un soulagement de la douleur d’environ 50% chez, à peu près, 50% des patients. Cela signifie, de toute évidence, que l’on doit rechercher d’autres éléments prédictifs de l'efficacité de cette SME. Dans cette perspective, il pourrait être intéressant d’établir des liens entre les mécanismes d'analgésie mis en jeu dans la SME et ceux, neurophysiologiques, impliqués dans les différents types de douleur chroniques. Il pourrait s’agir, par exemple, de l’enregistrement de l’activité spinale (réflexes-RIII nociceptifs) et corticale (potentiels évoqués somatosensoriels (PES). Certains travaux ont en effet permis de démontrer que les réflexes RIII préservés associés une activité de PES réduite (absence de déafférentation) seraient de très bons indicateurs de la réussite d’une SME 7. Recourant à des procédures similaires, d’autres chercheurs ont montré que la SME possédait des effets spinaux, supraspinaux et sympathiques tant sur les afférences nociceptives que non-nociceptives 8 . Ces résultats, mais aussi ceux d’autres équipes sur les mécanismes de SCS, seront importants pour nous permettre de mieux caractériser ces patients qui présentent un déficit spécifique en fonction de leur type de douleur neuropathique.
`
Fait intéressant, la recherche récente sur l'identification des mécanismes impliqués dans divers types de douleur chronique souligne le rôle crucial des mécanismes excitateurs — comme la sommation temporelle (ST) — en comparaison de ceux inhibiteurs — telle la modulation conditionnée de la douleur (MCD) — et aide à prédire la réponse à certains traitements pharmacologiques spécifiques. Ainsi la ST, mais pas la MCD, semble être un bon prédicteur de l’efficacité clinique d'un anticonvulsivant (prégabaline) dans la pancréatite chronique 9 tandis qu'une diminution de la MCD paraît être un bon indicateur de l'efficacité d'un antidépresseur (duloxétine) 10. Ces résultats, qui demandent à être confirmés, montrent que ce type d’approche serait utile afin d’identifier la nature du mécanisme mis en jeu suivant la douleur chronique et, ainsi, conduire à une meilleure sélection des traitements.
Récemment les travaux d’Eisenbert et al. ont évalué l'effet de la SME sur la sensibilisation centrale provoqué par la SME grâce à la mesure de ST. Cette hypothèse provient de modèles animaux ayant démontré que la SME permettait de réduire l'activité des « wide-dynamic-range neurons » connues pour être impliquée dans la sensibilisation centrale des douleurs neuropathiques 11. Dans cette étude, les auteurs ont montré que la SME diminuait la perception de la douleur clinique d'environ 50% et, fait intéressant, la ST a été significativement diminuée durant la SME mais exclusivement pour la jambe touchée. Ces résultats tendent à confirmer une réduction de la sensibilisation centrale par la SME. Néanmoins, il n'y avait pas de relation entre l'efficacité clinique et l'effet sur la ST, réduisant la probabilité qu’il existe un lien clair entre la SME, la sensibilisation centrale et la douleur clinique. Plusieurs explications possibles à cette discordance, premièrement, le faible échantillon de patient dont la puissance statistique a pu faire défaut pour détecter un lien entre la ST et la douleur clinique. Deuxièmement, cela peut signifier, aussi, que la SME agit sur la douleur — clinique et expérimentale — par des mécanismes variés. Néanmoins, ces résultats tendent à confirmer que l'efficacité de la SME dans la réduction de la douleur neuropathique est très probablement liée à un effet direct sur la sensibilisation centrale mesurée par la TS.
D’autre part, plusieurs études confirment la possibilité que des mécanismes supraspinaux puissent être impliqués dans la SME 6,12-14 . Il devient alors important d’évaluer l'effet placebo de ces approches en raison de la forte attente des patients et du désir de soulagement. Comme différents auteurs le soulignent, un design en double aveugle est difficile en raison de la perception des paresthésies. Malgré tout, il reste possible d’avoir un groupe contrôle contre placebo, cela a pu être réalisé dans la stimulation thalamique 15. Ces études menées avec des groupes contrôles placebo ont donnés des résultats discordants 16-18. De nouvelles études paraissent donc nécessaires afin de montrer la supériorité de la SME sur la stimulation placébo. Elles devraient montrer que la SME affecte — et est affecté — par le contrôle des centres supérieurs via les composantes émotionnelles de la douleur. Cela nous permettrait d’élargir notre compréhension de ces phénomènes complexes mis en jeu dans la neuromodulation.
Nous avons besoin de plus d'études, comme celle d’Eisenberg et al, sur la relation entre la SME et la modulation endogène de la douleur, afin d’accroître notre compréhension des phénomènes. A terme, cela devrait nous permettre d’établir de meilleurs critères de sélection des patients basés sur une évaluation clinique simple mais précise.
Bibliographie
1. Kane K, A. T. A history of local electrical analgesia. . Pain. 1975;1:125–138.
2. Melzack R, Wall PD. Pain mechanisms: a new theory. Science. 1965;150(3699):971-979.
3. Shealy CN, Mortimer JT, Hagfors NR. Dorsal column electroanalgesia. Journal of neurosurgery. 1970;32(5):560-564.
4. Guan Y. Spinal cord stimulation: neurophysiological and neurochemical mechanisms of action. Curr Pain Headache Rep. 2012;16(3):217-225.
5. Taylor RS, Desai MJ, Rigoard P, Taylor RJ. Predictors of pain relief following spinal cord stimulation in chronic back and leg pain and failed back surgery syndrome: a systematic review and meta-regression analysis. Pain practice : the official journal of World Institute of Pain. 2014;14(6):489-505.
6. Wolter T. Spinal cord stimulation for neuropathic pain: current perspectives. Journal of pain research. 2014;7:651-663.
7. Garcia-Larrea L, Peyron R, Mertens P, Laurent B, Mauguiere F, Sindou M. Functional imaging and neurophysiological assessment of spinal and brain therapeutic modulation in humans. Archives of medical research. 2000;31(3):248-257.
8. de Andrade DC, Bendib B, Hattou M, Keravel Y, Nguyen JP, Lefaucheur JP. Neurophysiological assessment of spinal cord stimulation in failed back surgery syndrome. Pain. 2010;150(3):485-491.
9. Olesen SS, Graversen C, Bouwense SA, van Goor H, Wilder-Smith OH, Drewes AM. Quantitative sensory testing predicts pregabalin efficacy in painful chronic pancreatitis. PLoS One. 2013;8(3):e57963.
10. Yarnitsky D, Granot M, Nahman-Averbuch H, Khamaisi M, Granovsky Y. Conditioned pain modulation predicts duloxetine efficacy in painful diabetic neuropathy. Pain. 2012;153(6):1193-1198.
11. Zhang T, Janik J, Grill W. Mechanisms and models of spinal cord stimulation for the treatment of neuropathic pain. . Brain Res 2014;1569:19–31.
12. Song Z, Ansah OB, Meyerson BA, Pertovaara A, Linderoth B. Exploration of supraspinal mechanisms in effects of spinal cord stimulation: role of the locus coeruleus. Neuroscience. 2013;253:426-434.
13. Smits H, van Kleef M, Holsheimer J, Joosten EA. Experimental spinal cord stimulation and neuropathic pain: mechanism of action, technical aspects, and effectiveness. Pain practice : the official journal of World Institute of Pain. 2013;13(2):154-168.
14. Barchini J, Tchachaghian S, Shamaa F, et al. Spinal segmental and supraspinal mechanisms underlying the pain-relieving effects of spinal cord stimulation: an experimental study in a rat model of neuropathy. Neuroscience. 2012;215:196-208.
15. Marchand S, Kupers RC, Bushnell MC, Duncan GH. Analgesic and placebo effects of thalamic stimulation. Pain. 2003;105(3):481-488.
16. Perruchoud C, Eldabe S, Batterham AM, et al. Analgesic efficacy of high-frequency spinal cord stimulation: a randomized double-blind placebo-controlled study. Neuromodulation : journal of the International Neuromodulation Society. 2013;16(4):363-369; discussion 369.
17. Lanza GA, Grimaldi R, Greco S, et al. Spinal cord stimulation for the treatment of refractory angina pectoris: a multicenter randomized single-blind study (the SCS-ITA trial). Pain. 2011;152(1):45-52.
18. Eddicks S, Maier-Hauff K, Schenk M, Muller A, Baumann G, Theres H. Thoracic spinal cord stimulation improves functional status and relieves symptoms in patients with refractory angina pectoris: the first placebo-controlled randomised study. Heart (British Cardiac Society). 2007;93(5):585-590.
L'analyse des caractéristiques psycho-sociales intervenant sur les résultats de la stimulation médullaire

La référence
L'article
Certains facteurs psychologiques ont pu être identifié comme influençant les résultats de la stimulation de la moelle épinière (SME) sans qu’il existe un véritable consensus sur l’impact de ces facteurs.
Cette étude prospective a été menée à Dudley au Royaume-Uni. Sur 65 patients initialement recrutés, 56 (31 femmes et 25 hommes) ont été suivis durant 12 mois après mise en place d’une SME dans le traitement de douleur chronique non cancéreuse. Les principaux critères de jugement ont été l'échelle visuelle analogique (EVA), l’indice d’invalidité d’Oswestry (ODI), les échelles d’anxiété et de dépression (HAD) ainsi qu’un questionnaire sur les stratégies d'adaptation à la douleur (PCSQ).
Une amélioration significatives a été constaté pour l’EVA (P <0,001), l’ODI (P = 0,011), l'anxiété (P = 0,042) et la dépression (P = 0,010) ainsi que sur les sous-échelles réinterprétant la sensation de douleur (P = 0,018), le contrôle de la douleur (P = 0,001), et la capacité de diminuer la douleur (P <0,001) de la PCSQ. Il a été observé que la dépression et l'adaptation (contrôle de la douleur et catastrophisme) pouvaient influer sur l'intensité de la douleur et l’invalidité. L’âge et la durée de la douleur avant l'implantation ont également un impact négatif sur l’efficacité de la SME
Cette étude démontre que des dimensions psychologiques comme la dépression et les mécanismes d’adaptation influent sur les résultats de la SME. Répondre à ces questions avant l'implantation pourrait améliorer les résultats à long terme.
Le commentaire
L’importance des stratégies fonctionnelles (persistance dans les activités, acceptation de la douleur, relaxation, maintient des activités socialisantes…) et dysfonctionnelles (dramatisation, restriction des activités, autoaccusation…) n’est plus a démontré et ce travail britannique vient souligner l’impact du « coping » dans la gestion de la douleur et des réactions émotionnelles qu’elle induit après la SME. Ces résultats plaident pour une prise en charge psychologique au long court des patients implantés.
Toutefois, il aurait été intéressant de savoir si les patients qui ont des croyances et des attentes irréalistes sur leurs états douloureux sont récusés par cette équipe pour implantation d’une SME. Il en va de même du catastrophisme qui fait partie des facteurs psychosociaux corrélés à un haut risque d’échec dans le traitement de la douleur. Concernant la dépression, on remarque que les patients qui en souffrent ont, après implantation, belle et bien une diminution de l’intensité de la douleur mais pas de leurs scores d’invalidité.
Une observation qui renvoie, sans doute, à la sempiternelle question de la dépression comme cause ou conséquence de la douleur chronique…
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
Le succès de la stimulation à haute fréquence après échec d'une stimulation médullaire traditionnelle

La référence
Smith H, Youn Y, Pilitsis JG. Successful use of high-frequency spinal cord stimulation following traditional treatment failure. Stereotact Funct Neurosurg. 2015 ; 93(3):190-193.
L'article
La stimulation de la moelle épinière à haute fréquence (SMEHF) offre une alternative dans le traitement des syndromes de douleur chronique réfractaire n’étant pas répondeurs à la stimulation de la moelle épinière (SME) traditionnelle. Après des travaux contradictoires sur la SME-HF effectuée à 5-10 kHz, cette étude tend à montrer l’efficacité clinique de la stimulation à la fréquence de 1 kHz par un générateur standard.
La SME-HF a été utilisée chez deux patients ayant eu un soulagement insuffisant avec la SME classique. Le stimulateur du premier patient avait été initialement programmé à 40 Hz et une largeur d'impulsion de 330 µs par stimulation bipolaire. Le soulagement étant inadéquat une reprogrammation a été effectuée à 1,15 kHz, 120 µs et 5 V. Chez le second patient — initialement programmée à 40 Hz et 390 µs — un nouveau réglage à une fréquence de 1,2 kHz et une largeur d'impulsion de 120 µs a permis un soulagement optimal de la douleur et une amélioration de la qualité de vie.
La SME-HF à 1 kHz — chez les patients pour qui les paramètres habituels de stimulation ont échoué — est une nouvelle possibilité de traitement chez les patients souffrant de douleur chronique irréductible et cela d’autant plus que la majorité des neurostimulateurs sont en mesure de délivrer cette gamme de fréquence.
Le commentaire
L’intérêt de cette étude ouverte portant seulement sur deux patients peut paraître limité. Néanmoins, elle possède l’intérêt de nous inciter à explorer d’autres modes de programmation — notamment l’augmentation de la fréquence — chez des patients pour qui la SME n’est plus efficace.
Le format qu’offre une publication n’est pas vraiment adapter à deux « case report » pourtant, aujourd’hui, il n’existe pas d’autres supports — exceptions faites des communications lors des congrès — permettant de partager les « surprises » cliniques qui sont parfois au rendez-vous suite à des modifications de paramètres. Un site web, par exemple, pourrait offrir l’outil adéquat permettant aux praticiens concernés de partager leur retour d’expérience (observations cliniques selon les paramètres de stimulation donnés).
L’infinité de combinaisons qu’offrent les techniques de neuromodulation aurait tout à gagner de cette intelligence en réseau.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
Le traitement corticale de la douleur neuropathique lors de la stimulation médullaire

La référence
L'article
Plusieurs mécanismes ont été avancés afin d’expliquer l'effet bénéfique de la stimulation de la moelle épinière (SME) chez les patients souffrant de douleur neuropathique (DN), mais l’on sait peu de choses des mécanismes supraspinaux susceptible d’y contribuer. Cette étude — par enregistrement des potentiels corticaux — a été menée chez des patients souffrant de douleurs neuropathiques dont la SME a permis une diminution des DN.
Il s’agit d’une étude observationnelle mené auprès de neuf patients souffrant de DN d’un membre inférieur pour qui la SME s’est avérée efficace. L'activité corticale a été analysée par électroencéphalogramme (EEG) lors de stimulation douloureuse ou non-douloureuse. Chaque patient a été évalué alors que la SME fonctionnait ou 24h après son arrêt. Les aires corticales impliquées ont été localisée en utilisant une méthode basée sur un modèle de dipôle fixe.
Il a été observé que le seuil des potentiels — en fonction de la détection et de l’intensité — lors d’une stimulation non douloureuse ne différait pas significativement d’un hémisphère à l’autre. En revanche, lors d’une stimulation douloureuse, le seuil de ces potentiels était plus bas du côté de la douleur neuropathique (p = 0,03). Les seuils de douleur étaient significativement plus faibles de manière bilatérale (p = 0,03 côté sain, p = 0,003 côté des DN) chez cinq patients après l’arrêt de cette SME. Sous l'effet de la SME les négativités corticales (N1, N2, N3) et la positivité (P1) possédaient des amplitudes comparables de façon bilatérale. Après arrêt de la SME la diminution de seuil pour une stimulation périphérique se traduisait par un abaissement des négativités de façon bilatérale tandis que la positivité, P1, était réduite surtout du côté exempt de DN. N2 a pu être localisée au niveau de la représentation sensorielle de la jambe sur l'homonculus. P1 a été localisée au niveau du cortex cingulaire (CC) et avait tendance à se déplacer en avant sous l’influence de la SME.
À long terme la SME semble influencer le seuil douloureux au niveau cortical. La localisation P1 suggère la participation des régions impliquées dans le traitement émotionnel, cognitif et associatif de la douleur.
Le commentaire
Malgré son faible effectif — qui nous amène à l’interpréter avec précaution — cette étude aboutit à des conclusions déjà connues, mais obtenues de façons différentes. En 1974, J. Krainick1 avait déjà montré que la SME abaissait le seuil douloureux du côté de la DN. Cette étude, qui nous montre que le seuil douloureux est abaissé de façon bilatérale, plaide effectivement en faveur d’un contrôle supra-spinal de la douleur par la SME.
Concernant la topographie de ce contrôle supra-spinal — cortex cingulaire — les conclusions de cette équipe allemande corroborent celles obtenues, avec une meilleure résolution spatiale, par l’imagerie fonctionnelle2-6 . L’intérêt de cet article réside donc l’approche originale qu’est le recourt à l’EEG dans ce type d’exploration.
Bibliographie
1. Krainick JU, Thoden U. Experience with dorsal column stimulation (DCS) in the operative treatment of chronic intractable pain. J Neurosurg Sci. 1974;18(3):187-189.
2. Kishima H, Saitoh Y, Oshino S, et al. Modulation of neuronal activity after spinal cord stimulation for neuropathic pain; H(2)15O PET study. Neuroimage. 2010;49(3):2564-2569.
3. Moens M, Sunaert S, Marien P, et al. Spinal cord stimulation modulates cerebral function: an fMRI study. Neuroradiology. 2012;54(12):1399-1407.
4. Stancak A, Kozak J, Vrba I, et al. Functional magnetic resonance imaging of cerebral activation during spinal cord stimulation in failed back surgery syndrome patients. European journal of pain. 2008;12(2):137-148.
5. Rasche D, Siebert S, Stippich C, et al. [Spinal cord stimulation in Failed-Back-Surgery-Syndrome. Preliminary study for the evaluation of therapy by functional magnetic resonance imaging (fMRI)]. Schmerz. 2005;19(6):497-500, 502-495.
6. Kiriakopoulos ET, Tasker RR, Nicosia S, Wood ML, Mikulis DJ. Functional magnetic resonance imaging: a potential tool for the evaluation of spinal cord stimulation: technical case report. Neurosurgery. 1997;41(2):501-504.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
La stimulation médullaire est-elle vraiment sans danger ? une revue de ses complications

La référence
L'article
Ce travail vise à évaluer les complications de la stimulation de la moelle épinière (SME) au travers d’une revue de la littérature. Outre les complications de cette technique cet article nous oriente vers des méthodes de prévention, de diagnostic et de traitement.
La migration de l'électrode apparaît comme la complication la plus courante (1,5 à 13,2%) et parait plus fréquentes avec des électrodes percutanées qu’avec celles chirurgicales. Une migration qui souvent peut être résolu par la reprogrammation du stimulateur, mais si elle échoue, abouti à un repositionnement chirurgical (3,8 à 23%). Plusieurs techniques d'ancrage sont décrites. L'infection est une complication potentiellement réductible plutôt associée à la procédure chirurgicale. Les taux d'infection rapportés (2,5 à 14%) semblent comparables à ceux des autres dispositifs de neuromodulation, les auteurs énumèrent les précautions visant à prévenir ces épisodes infectieux. D'autres complications sont examinées comme les ruptures d’électrode ou de câbles (3 à 9%), fuite de liquide céphalo-rachidien (0,3-7%), les douleurs au niveau du neurostimulateur (0,9 à 12%), les séromes ou hématomes sous-cutanées (9%), une paralysie transitoire inexpliquée (1,8%) et l'hématome épidural (0,19 à 0,9%).
En dépit de l'existence de plusieurs complications la SME peut être considérée comme une technique sûre avec des séquelles irréversibles très faibles en outre l'incidence de complications potentiellement mortelles sont extrêmement faibles. Le médecin doit être en mesure de reconnaître ces incidents durant le suivi. La majorité des complications peuvent être évitées — ou diminués — par l'exécution d'une technique chirurgicale aseptique rigoureuse ainsi que par une sélection stricte des patients avant l'implantation.
Le commentaire
Cette revue de la littérature, bien documentée, permettra au praticien d’informer le patient avec précision — par des chiffres actualisés — des risques encourus lors de cette chirurgie planifiée. Les mesures préventives qui y sont détaillés méritent d’être relue par tous les praticiens réalisant ces procédures notamment celles visant à prévenir la survenue d’infection (antibiothérapie prophylactique, éviter d’implanter du matériel à l’aplomb des cicatrices, durée de la période test...).
Il est frappant de constater — comme souvent dans pareil type d’étude — l’écart important des taux pour une même complication. Les différences méthodologiques (études rétrospectives versus prospectives) et les variantes de matériels en sont une explication de même que les définitions utilisées.
Dr Marc Lévêque
Une information plus exhaustive est disponible sur le site d'Actudouleurs auquel l'auteur contribue régulièrement
Stimulation médullaire dans la douleur chronique : l'importance de référer rapidement

La référence
L'article et le commentaire
L’année qui vient de s’écouler a vu la disparition, à 83 ans, du Canadien Krishna Kumar, pionnier de la stimulation médullaire épidurale. Au travers de son dernier éditorial paru tout récemment dans Pain Management, la revue de presse de ce mois est l’occasion de lui rendre hommage.
Le chirurgien de l’Université du Saskatchewan nous rappelle que la douleur neuropathique (DN) est une maladie en soi ayant un important retentissement psychosocial dont la prévalence est d’environ 8-9% en Amérique du Nord 1. Face à cette douleur répondant mal aux traitements pharmacologiques et chirurgicaux, la stimulation de la moelle épinière (SME) paraît être la seule option de « traitement viable ». Kumar précise que l'utilisation de la SME est aujourd’hui soutenue par des essais contrôlés randomisés, des méta-analyses, des études de coût-efficacité et que ses atouts résident dans sa réversibilité, ses faibles risques, et son adaptabilité. Des avantages qui se traduisent par un soulagement de la douleur, une amélioration de l’état fonctionnel, de la qualité de vie ainsi qu’une réduction des coûts de santé 2-5 .
Il existe dorénavant un large consensus parmi les experts, estime le neurochirurgien, pour considérer que la SME devrait être proposée aux patients souffrant de douleurs neuropathiques ne répondant peu ou pas aux traitements conventionnels, cela après un délai de 12 à 16 semaines. Il a en effet été démontré que l'efficacité du traitement par SME dépendait de la précocité de l’implantation. Les taux de réussite dépassement 80% lorsque l'implantation intervient dans les 2 ans de l'apparition des symptômes contre 5% chez les malades implantés 20 ans après l'apparition de cette douleur 6-9 . Des données qui révèlent qu’une attente de 5,45 années se traduit par un taux de succès à long terme de 47% 6,9 . L’analyse indique que les patients sont confrontés, à chaque étape de la chaîne de traitement, à des retards importants dans l'accès à la SME. Généralement, les patients consultent leur médecin traitant seulement 3,4 mois après le développement d’une DN. Les médecins de famille prennent alors en charge ces malades durant 11,9 mois avant de passer la main. Le retard le plus important survient dans la prise en charge spécialisée qui dure 39,8 mois supplémentaires. Des écarts importants sont constatés suivant le spécialiste consulté. Au travers de ces chiffres, Kumar, déplore que le dogme — erroné — de la SME comme « traitement de la dernière chance » soit encore vivace chez nos confrères cela en dépit de preuves accablantes démontrant le contraire.
Il ajoute que si l’accès rapide à un traitement efficace est primordial 7,10 , c’est loin d’être le cas avec la SME. L'Association Internationale pour l'Etude de la Douleur (IASP) préconise que les temps d'attente pour l'évaluation par un spécialiste de la douleur ne soit pas supérieur à huit semaines 6,9 . Des recommandations qui, si elles étaient adoptées, ferait chuter le temps d'attente d’une SME. Le recours à des critères de sélection augmenterait la vitesse d’accès à la SME. Une indication précoce — et à bon escient — de la SME permettrait ainsi d'améliorer la restauration fonctionnelle et donc le retour au travail.
Malgré des preuves solides, le recours à la SME demeure désespérément bas, regrette Kumar. Une analyse rétrospective portant sur 16 455 patients souffrant de FBSS a montré que 2,4% des patients se sont vus proposés une SME tandis que 97,6% ont été réopéré 11 . Ainsi, trop souvent, le candidat idéal à une SME se voit ballotté entre des gestes de réintervention chirurgicaux et de long cycle médicamenteux.
Ce constat regrettable s’explique, en partie, par une mauvaise information du Public. Selon une enquête européenne récente, 61% des patients implantés n’ont jamais entendu parler de la SME 12. En outre, il est apparu que 87% de ces patients ont expérimenté au moins quatre prises en charge différentes avant que la possibilité d’une SME ne soit évoquée. Parmi les malades informées de l’existence de la SME, quelques-uns l’ont été par leur médecin traitant ou spécialiste, mais la majorité grâce à la télévision ou Internet 12,13 .
Kumar ajoute que de récentes études d’imagerie fonctionnelle démontraient que la douleur chronique accélérait l’atrophie de la matière grise (perte de 1,3 cm3 par an, soit 5 à 11% de volume par an) 14. Cela suggérerait, selon lui, que la douleur chronique se comporte comme un trouble neurodégénératif et renforce l’idée d’une implantation précoce.
Même si le fardeau de la douleur chronique ne cesse de croître, la recherche dans ce domaine n’est guère une priorité. Une analyse des financements par le NIH a révélé que les crédits pour la recherche sur la douleur ont diminué en moyenne de 9,4% par an entre 2003 et 2007. Le budget total NIH alloué à la recherche contre la douleur est tombé à 0,61% en 2007 15.
Le neurochirurgien canadien conclut son dernier article en expliquant qu’un recours précoce à la SME améliorerait les résultats fonctionnels et peut-être, aussi, cette atrophie cérébrale — tant redoutée — qui serait favorisée par la douleur chronique.
Bibliographie
1. Yawn BP, Wollan PC, Weingarten TN, Watson JC, Hooten WM, Melton LJ, 3rd. The prevalence of neuropathic pain: clinical evaluation compared with screening tools in a community population. Pain Med. 2009;10(3):586-593.
2. Kumar K, Taylor RS, Jacques L, et al. The effects of spinal cord stimulation in neuropathic pain are sustained: a 24-month follow-up of the prospective randomized controlled multicenter trial of the effectiveness of spinal cord stimulation. Neurosurgery. 2008;63(4):762-770; discussion 770.
3. Kumar K, Rizvi S. Historical and present state of neuromodulation in chronic pain. Curr Pain Headache Rep. 2014;18(1):387.
4. Kumar K, Rizvi S. Cost-effectiveness of spinal cord stimulation therapy in management of chronic pain. Pain Med. 2013;14(11):1631-1649.
5. Kumar K, Hunter G, Demeria D. Spinal cord stimulation in treatment of chronic benign pain: challenges in treatment planning and present status, a 22-year experience. Neurosurgery. 2006;58(3):481-496; discussion 481-496.
6. (2010). IAftSoP. International Association for the Study of Pain 2010 Annual Report. http://www.iasppain.org/files/Content/ ContentFolders/AboutIASP/ IASPAnnualReport_2010.pdf. 2010.
7. Stanton-Hicks MD, Burton AW, Bruehl SP, et al. An updated interdisciplinary clinical pathway for CRPS: report of an expert panel. Pain practice : the official journal of World Institute of Pain. 2002;2(1):1-16.
8. Kumar K, Rizvi S, Bnurs SB. Spinal cord stimulation is effective in management of complex regional pain syndrome I: fact or fiction. Neurosurgery. 2011;69(3):566-578; discussion 5578-5580.
9. Kumar K, Rizvi S, Nguyen R, Abbas M, Bishop S, Murthy V. Impact of wait times on spinal cord stimulation therapy outcomes. Pain practice : the official journal of World Institute of Pain. 2014;14(8):709-720.
10. Lynch ME, Campbell F, Clark AJ, et al. A systematic review of the effect of waiting for treatment for chronic pain. Pain. 2008;136(1-2):97-116.
11. Lad SP, Babu R, Bagley JH, et al. Utilization of spinal cord stimulation in patients with failed back surgery syndrome. Spine. 2014;39(12):E719-727.
12. Research. I. The painful truth survey: State of pain management in Europe. . http://www.epresspack.net/mnr/ download/?id=4763&pn=937949-pdf.
13. Thomson S, Jacques L. Demographic characteristics of patients with severe neuropathic pain secondary to failed back surgery syndrome. Pain practice : the official journal of World Institute of Pain. 2009;9(3):206-215.
14. Apkarian AV, Sosa Y, Sonty S, et al. Chronic back pain is associated with decreased prefrontal and thalamic gray matter density. J Neurosci. 2004;24(46):10410-10415.
15. Bradshaw DH, Empy C, Davis P, et al. Trends in funding for research on pain: a report on the National Institutes Of Health grant awards over the years 2003 to 2007. J Pain. 2008;9(12):1077-1087, 1087.e1071-1078.
La stimulation médullaire dans les douleurs post-opératoires de chirurgie du rachis

La référence
L'article
Le Failed Back Surgery Syndrome (FBSS) est l’un des grands pourvoyeurs de douleurs neuropathiques et, jusqu’à présent, les rares travaux ayant comparé la réintervention à la stimulation médullaire avaient porté sur de petits effectifs. Cette analyse rétrospective des données d'Assurances Maladies américaines a cherché à évaluer l’utilisation de la stimulation de la moelle épinière (SME) en la comparant à la réintervention dans le traitement du FBSS et en évaluant ses coûts et complications. L'ensemble des données d’une cohorte de 16 455 patients souffrant de FBSS entre 2000 et 2009 a été étudié. Parmi eux 395 (2,4%) avaient bénéficié d’une SME. Les taux de complications à 90 jours étaient significativement plus réduits parmi les patients porteurs d’une SME comparés à ceux réopérés (p < 0,0001). Dans une cohorte appariée le séjour hospitalier (p < 0,0001) et les frais associés (p = 0,016) étaient plus faibles pour les patients avec une SME tandis qu’en ambulatoire (consultations, urgences et frais de médicaments) ses coûts devenaient similaires entre les deux groupes. À deux ans, le coût global apparaît légèrement plus élevé parmi les malades réopérés (82 586$) comparés à ceux ayant une SME (80 669$) sans, toutefois, que cela soit significatif (p = 0,88).
Le commentaire
On connaissait depuis l’étude de North et col. [1] en 2005 — portant sur un nombre restreint de patients — la supériorité de la SME comparée à un nouveau geste rachidien dans le FBSS. De son côté, l’étude PROCESS [2]a montré que, parmi deux populations appariées de patients souffrant de FBSS, à 6 mois, 48% des patients porteurs d’une SME étaient soulagés (>50% de l’EVA) contre 9% de ceux bénéficiant d’un traitement médical classique (TMC). PROCESS montrait, à cinq ans, que le coût était de 38 029 $ pour le groupe TMC contre 29 123$ dans le groupe SME.
Cette étude américaine publiée dans la revue Spine de ce mois-ci vient, à plus grande échelle, confirmer ces données. Elle montre que, si la SME ne semble pas diminuer de façon drastique les coûts de santé, en revanche, ses résultats satisfaisants et son faible taux de complication justifie son recours plus large dans le FBSS.
Toutefois, on est étonné de constater, d’une publication à l’autre, que les évaluations de coût puissent être aussi radicalement différentes : dans cet article de Spine le coût de la SME s’élève à plus du double de celle de l’étude PROCESS pour une durée de deux ans au lieu de cinq !
Dr Marc Lévêque
[1] North RB, Kidd DH, Farrokhi F, Piantadosi SA. Spinal cord stimulation versus repeated lumbosacral spine surgery for chronic pain: a randomized, controlled trial. Neurosurgery. 2005;56(1):98-106; discussion 106-107.
[2] Kumar K, Taylor RS, Jacques L, et al. The effects of spinal cord stimulation in neuropathic pain are sustained: a 24-month follow-up of the prospective randomized controlled multicenter trial of the effectiveness of spinal cord stimulation. Neurosurgery. Oct 2008;63(4):762-770; discussion 770
Une information plus exhaustive est disponible sur le site d'Actudouleurs auquel l'auteur contribue régulièrement
La stimulation médullaire chez les patients souffrant de neuropathie diabétique douloureuse

La référence
L'article
La neuropathie diabétique douloureuse (NDD) compte parmi les douleurs neuropathiques périphériques les plus difficiles à soulager. Cette étude scandinave multicentrique et randomisée évalue l’efficacité de la stimulation médullaire épidurale (SME) dans cette indication. Soixante patients souffrant de NDD dans les extrémités inférieures, réfractaires au traitement médical conventionnel, ont été recrutés et suivis pendant six mois. Ils ont été randomisés en deux groupes : 1 — meilleure pratique conventionnelle médicale avec SME (n=40) et 2 — idem mais sans SME (n=20, groupe de contrôle). Les deux groupes ont été suivis à intervalles réguliers. A chaque visite, le EuroQoL 5D, le McGill Pain Questionnaire (SF-MPQ) et une échelle visuelle analogique (VAS, allant de 0-100) pour mesurer l'intensité de la douleur ont été renseignés. Au départ, le score moyen de VAS était de 73 dans le groupe SME et 67 dans le groupe de contrôle. Après six mois de traitement, la valeur moyenne de l'EVA est tombée à 31 dans le groupe SME (p <0,001) tandis qu’elle se maintenait à 67 (p=0,97) dans le groupe témoin (Figure a). Les questionnaires SF-MPQ et EuroQoL 5D ont également montré une amélioration de l’état général et de la qualité de vie à l’issue des six mois de traitement. On ne déplore pas plus d’infection de matériel chez cette population pourtant davantage sujette à ce type de complication.
Le commentaire
On regrettera le suivi limité ainsi que l’absence de double aveugle dans cette étude. L’existence de paresthésie lors de la mise en route de la SME rend, toutefois, cette méthodologie impossible. L’apparition de la stimulation en « rafale » et/ou à haute fréquence devrait, à l’avenir, permettre de pallier à cette faiblesse méthodologique. Rappelons qu’avec ces nouvelles techniques, les paresthésies ne sont plus nécessaires au soulagement. Même en considérant ces limites, ces résultats peuvent être jugé comme très encourageants. Ils méritent, à ce titre, que l’on considère plus souvent et plus rapidement la SME dans le traitement des douleurs neuropathiques irréductibles des patients diabétiques.
Dr Marc Lévêque
Une information plus exhaustive est disponible sur le site d'Actudouleurs auquel l'auteur contribue régulièrement
Les effets des mouvements et des changements posturaux dans la stimulation médullaire avec les nouveaux systèmes de rechargement

La référence
L'article
Malgré les développements récents dans les dispositifs de neurostimulation implantables, l'ajustement des niveaux de stimulation lors des changements de position du patient demeure problématique. Cette étude a été menée avec les plus récents appareils rechargeables afin de comparer leurs résultats et ceux de systèmes conventionnels.
Cette étude prospective a suivi 46 patients avec un système implanté de stimulation rechargeable. L'impédance, les seuils de stimulation, l'intervalle thérapeutique, la satisfaction des patients ont été mesurés ainsi que les sensations en fonction des différentes positions.
Le FBSS et le SDRC étaient les pathologies les plus fréquentes chez ces 46 patients. L'amplitude la plus basse nécessaire pour atteindre les différents seuils était la position de décubitus dorsal. Pour tous les seuils de stimulation, il existait une différence entre la position couchée sur le dos et les autres postures. Cependant, aucune différence statistiquement significative n’a été retrouvée concernant la satisfaction en fonction des différentes positions.
Les résultats de la présente étude sont similaires à ceux décrits dans des publications antérieures et montrent une relation entre les changements de position et les seuils de stimulation. La position qui réclame la plus faible énergie — et dont la zone thérapeutique est la plus étroite — reste le décubitus dorsal.
Le commentaire
Les résultats de cette étude sont sans surprise puisqu’ils confirment une constatation bien connue de tous et largement documentée dans la littérature : l’intensité de la stimulation nécessite des ajustements selon la position du patient. L’originalité de ce travail espagnol tient au fait que, pour la première fois, des stimulateurs rechargeables sont étudiés.
Même si ces données n’apportent rien de nouveau, elles soulignent néanmoins la pertinence d’une gamme récente de neurostimulateurs rechargeables (RestorSensor de Medtronic ®) — qui n’a pas été étudié dans cette série — munis d’accéléromètre permettant d’identifier la position du patient et d’adapter, en conséquent, l’intensité de la stimulation. Malheureusement cette technologie, à notre connaissance, n’est pas encore disponible avec les dispositifs non rechargeables.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
Suivi à long terme des patients après remplacement d'électrodes percutanées par des électrodes chirurgicales par une étude retrospective

La référence
Matias CM, Amit A, Lempka SF, et al. Long-term Outcomes After Replacement of Percutaneous Leads With Paddle Leads in a Retrospective Cohort of Patients With Spinal Cord Stimulation Systems. Neurosurgery. Jun 30 2014.
L'article
Les résultats à long terme de la stimulation de la moelle épinière (SME) sont connus en revanche ceux des patients ayant subi une révision et un remplacement de leurs électrodes percutanées par des électrodes chirurgicales le sont beaucoup moins. Les auteurs présentent les résultats à long terme de 39 patients traités par électrodes percutanées ensuite remplacées par des électrodes chirurgicales.
Le suivi a porté sur l’intensité de la douleur, le degré d'invalidité ainsi que le territoire des douleurs chroniques et la somatotopie des paresthésies provoquées par la stimulation. L’enquête s’est faite par des questionnaires envoyés par la poste. Une analyse a été effectuée en fonction de l'âge, du sexe, du type de douleur, de la durée de la maladie, du nombre de reprises chirurgicales, des complications et de l'intervalle entre les différentes chirurgies.
Suite à la révision chirurgicale, 20 patients (50%) présentaient une réduction d’au moins 3 points sur l'échelle d'évaluation numérique (EN). Cette réduction de la douleur était corrélée à une meilleure couverture (P = 0,001). La couverture était meilleure chez les patients ayant une révision comparée à ceux qui en avaient eu de multiples (P = 0,01). Vingt-cinq patients (62,5%) ont rapporté une bonne satisfaction et ont indiqué qu'ils seraient prêts à subir la même procédure en vue d'atteindre les mêmes résultats. Ces patients ont eu une réduction significativement plus importante de la douleur (p = 0,001) et une meilleure couverture (P = 0,002) que les patients qui ont déclaré le contraire. Aucune complication majeure n’a été déplorée.
La révision d’un système de SME percutanée au profit d’une électrode chirurgicale apparaît sûre et plus efficace à condition qu’ils n’aient pas subi plus d'une révision préalable.
Le commentaire
Les électrodes percutanées possèdent l’avantage d’être inséré avec un minimum de dissection des tissus et donc des douleurs postopératoires moindres.
Elles ont néanmoins l’inconvénient — comparé aux électrodes chirurgicales — d’un risque de migration ultérieur plus élevé. Dans ce cas, le phénomène de fibrose épidurale rend le repositionnement par voie percutanée problématique.
Cette étude de la Cleveland Clinic s’est donc donnée pour objectif de valider la stratégie qui vise à remplacer l’électrode percutanée par une chirurgicale en cas de migration. Les résultats valident cette hypothèse.
Néanmoins, l’hétérogénéité des patients inclut dans cette cohorte (étiologies variées des douleurs, électrodes thoraciques et cervicales, remplacement par des électrodes uni/bi/tri-colonnes, suivi s’étalant de 14 à 69 mois) et les modalités de l’étude (questionnaires rétrospectifs par courrier postal) en affaiblissent la conclusion.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
Le recours à la stimulation médullaire chez les patients souffrants de FBSS

La référence
Lad SP, Babu R, Bagley JH, Choi J, Bagley CA, Huh BK, Ugiliweneza B, Patil CG, Boakye M (2014) Utilization of Spinal Cord Stimulation in Patients with Failed Back Surgery Syndrome. Spine 2014 May 20;39(12):E719-27.
L'article
Le FBSS est une source importante de douleurs neuropathiques et affecte jusqu'à 40 % des patients opérés de la colonne vertébrale lombosacrée. Jusqu'à présent peu d'analyses économiques ont comparé les différents traitements effectués dans le FBSS et ces études portaient sur des échantillons de petite taille. Cette étude — qui repose sur l’analyse rétrospective des données d'assurances maladies — cherche à évaluer l’utilisation de la stimulation de la moelle épinière (SME) en la comparant à la réintervention dans le traitement du Failed Back Surgery Syndrome (FBSS), en évaluant ses complications et ses coûts.
L'ensemble des données des patients souffrant de FBSS entre 2000 et 2009 a été traité par MarketScan ®. Une méthode d’appariement par « score de propension » a été utilisée pour comparer les patients traités par SME de ceux réopérés. Quant aux complications postopératoires, elles ont été analysées par une régression logistique multivariée.
La cohorte de l'étude comprenait 16 455 patients souffrant de FBSS. Parmi eux 395 (2,4%) avaient bénéficié d’une SME. Les taux de complications à 90 jours étaient significativement plus faibles parmi les patients SME comparés à ceux réopérés (p < 0,0001). Toujours dans cette cohorte appariée le séjour hospitalier (p < 0,0001) et les frais associés (p = 0,016) étaient plus faibles pour patients porteurs d’une SME. En revanche, en ambulatoire (consultations, urgences et frais de médicaments) les coûts étaient similaires entre les deux groupes. A deux ans, le coût global était légèrement plus élevé dans le groupe des patients réopérés (82 586$) comparé à ceux ayant une SME (80 669$) sans que cela soit significatif (p = 0,88).
Si de nombreuses études, dans le FBSS, ont établis la supériorité de la SME, cette dernière demeure sous-utilisée. La SME ne semble pas diminuer de façon drastique les coût de santé en revanche ses résultats satisfaisants et son faible taux de complication justifie un recourt plus large dans le FBSS.
Le commentaire
Aux Etats-Unis Kumar et al1 ont montré, parmi deux populations appariées de patients souffrant de FBSS, qu’à 6 mois, 48 % des patients porteurs d’une SME étaient soulagés (> 50 % de l’EVA) contre 9 % de ceux bénéficiant d’un traitement médical classique (TMC). Ils ont également démontré, à 5 ans, que le coût était de 38 029$ pour le groupe TMC contre 29 123$ dans le groupe SME.
En France, Blond et al.2 étaient parvenues à des conclusions similaires : l’investissement matériel est compensé par une réduction immédiate, significative, et stable du coût des autres thérapeutiques. North et al. 3 ont démontré — sur un nombre limité de patients — la supériorité de la SME comparée à un nouveau geste rachidien dans le FBSS.
Cette étude américaine publiée dans la revue Spine à plus grande échelle, confirmer ces différents travaux. Dans l’hypothèse d’une réintervention, elle montre que, si la SME ne semble pas diminuer de façon drastique les coûts de santé, en revanche, ses résultats satisfaisants et son faible taux de complication justifie son recours plus large dans le FBSS.
Toutefois, on peut s’étonner de noter que, d’une publication à l’autre, ces évaluations de coût puissent être aussi radicalement différentes : dans cet article de Lad et al. le coût de la SME s’élève à plus du double de celle de l’étude de Kumar et al. pour une durée de 2 ans au lieu de 5 !
Bibliographie
1. Kumar K, Taylor RS, Jacques L, et al. Spinal cord stimulation versus conventional medical management for neuropathic pain: a multicentre randomised controlled trial in patients with failed back surgery syndrome. Pain. Nov 2007;132(1-2):179-188.
2. Blond S, Buisset N, Dam Hieu P, et al. [Cost-benefit evaluation of spinal cord stimulation treatment for failed-back surgery syndrome patients]. Neuro-Chirurgie. Sep 2004;50(4):443-453.
3. North RB, Kidd DH, Farrokhi F, Piantadosi SA. Spinal cord stimulation versus repeated lumbosacral spine surgery for chronic pain: a randomized, controlled trial. Neurosurgery. 2005;56(1):98-106; discussion 106-107.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
Prévention du déplacement d'une électrode percutanée : une expérience de 15 ans
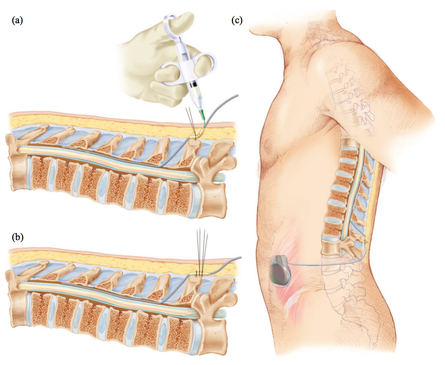
La référence
North RB, Recinos VR, Attenello FJ, Shipley J, Long DM (2014) Prevention of Percutaneous Spinal Cord Stimulation Electrode Migration: A 15-Year Experience. Neuromodulation 11 Fev 2014
L'article
Les électrodes percutanées de stimulation de la moelle épinière (SME) ont une propension à migrer longitudinalement ce qui peut représenter une complication — parfois coûteuse — pouvant compromettre l’effet thérapeutique. Par des modifications simples de la technique d'ancrage, ces migrations peuvent être éliminées.
Une série consécutive de patients a été analysée rétrospectivement. Initialement l’électrode percutanée était immobilisée par l’injection de < 0,1 cm3 de colle au niveau du manchon de silicone encrant l’électrode à l’aponévrose. Suite à la survenue entre 1998 et 2006 de migration avec des manchons courts, ces derniers ont été remplacés par des longs, d’aspect coniques. De 2007 à 2013, la technique a également été améliorée en pratiquant une incision aponévrotique accueillant la pointe de l'ancre et du matériel de suture plus résistant.
Dans la première série allant jusqu’en juillet 2007 et totalisant 291 patients dont le suivi moyen était de 4,75 ans (1,1-9) 4 migrations d'électrode (1,37%) ont nécessité une reprise chirurgicale. Seulement une électrode avait coulissé sur son point d'ancrage. Aucune migration n’a ensuite été déplorée dans la seconde série de 142 patients suivis jusqu’en 2013 dont le suivi moyen était de 2,86 ans, (0,10—5,45).
Les améliorations — simples et peu coûteuses — apportées à la technique ont permis d’éliminer la complication la plus fréquente de la SME.
Le commentaire
Le risque accru de migration compte parmi les inconvénients importants des électrodes percutanées par rapport aux électrodes chirurgicales. Une étude 1 menée sur 9072 patients a montré que le taux de ré-intervention, après la sortie de l’hôpital — dans la majorité des cas pour corriger une migration — était de 16,2% avec les électrodes percutanées contre 9% avec celles chirurgicales. Les chiffres avancés par l’équipe de Baltimore apparaissent donc bien meilleurs y compris avant le recours à de nouveaux systèmes d’ancrage.
Ces résultats très satisfaisants ne sont pas seulement liés aux perfectionnements du matériel, mais aussi à l’expertise des implanteurs, l’équipe de North étant l’une de celles ayant la plus grande et la plus ancienne expérience dans ce domaine.
Bibliographie
1. Babu R, Hazzard MA, Huang KT, et al. Outcomes of Percutaneous and Paddle Lead Implantation for Spinal Cord Stimulation: A Comparative Analysis of Complications, Reoperation Rates, and Health-Care Costs. Neuromodulation : journal of the International Neuromodulation Society. May 3 2013.
Dr Marc Lévêque
Les facteurs prédictifs d'amélioration de la qualité de vie et du périmètre de marche chez les patients ayant bénéficié d'une stimulation médullaire
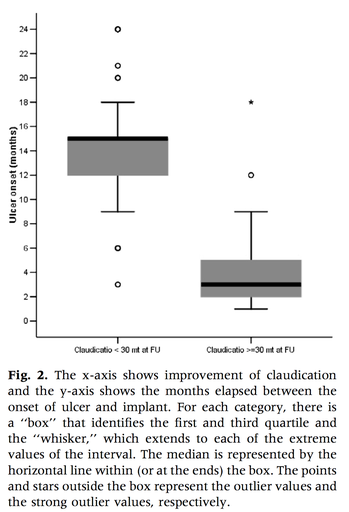
La référence
L'article
L'objectif de cette étude était de déterminer les facteurs prédictifs d’amélioration de la qualité de vie et de la claudication chez les patients bénéficiant d’une stimulation de la moelle épinière (SME) pour le traitement d’une ischémie des membres inférieurs.
Il s’agit d’une étude rétrospective chez 101 patients consécutifs atteints d’une claudication de quelques mètres traités par SME entre 1995 et 2012. Aucun ne pouvait bénéficier d’un geste de revascularisation et tous ont bénéficié d’un traitement médicamenteux optimal des ulcères les mois précédent le geste d’implantation. La qualité de vie a été évaluée à l’aide questionnaire SF-36. Il a été considéré qu’une amélioration de la qualité de la marche était obtenue dès lors que 30 mètres supplémentaires sans douleur pouvait être effectué sans douleur. Cette valeur a été définie comme « succès fonctionnel ». Une régression logistique a été utilisée afin d’évaluer les autres variables comme prédictives possibles de ce succès fonctionnel.
Aucune mortalité périopératoire ou complication significative n’a été observée. Après un suivi médian de 69 mois (1-202), la mortalité, l’amputation, et l’amputation partielle ont été respectivement de 8,9 %, 5,9% et 6,9 %. Un succès clinique fonctionnel a été observé dans 25,7% des cas. Les facteurs prédictifs indépendants de la réussite fonctionnelle lors de l'analyse uni-variée étaient le délai entre l'apparition de l'ulcère et la SME (p<0,001) et la distance de marche sans douleur avant SME (p<0,002). Le seul facteur prédictif de la réussite fonctionnelle en analyse multi-variée était le délai entre l'apparition de l'ulcère et la SME (le délai médian chez les patients avec et sans succès fonctionnel était respectivement de 3 et 15 mois). Il a été observé, pour un même périmètre de marche sans douleur que le taux de réussite diminuait de 40 % pour chaque mois écoulé séparant l’apparition de l’ulcère de l’implantation de la SME.
Dans cette série le délai entre l'apparition de l'ulcère et la SME est inversement corrélé à l’amélioration de la qualité de vie et du périmètre de marche. De plus grands effectifs sont nécessaires pour confirmer ces résultats.
Le commentaire
Il est maintenant établi que la SME permet de diminuer les douleurs, d’augmenter les valeurs de TcPO2 et d’améliorer le stade clinique (passage d’un stade III à II selon Fontaine) des ischémies des membres inférieurs inaccessible à la revascularisation1. On sait, en revanche, que les ulcères ne sont que peu — ou pas — améliorés par la stimulation. Le travail de cette équipe d’un service de chirurgie vasculaire milanais démontre le bénéfice à proposer rapidement la SME après l’apparition de l’ulcère. Les précédentes études qui s’étaient penchées sur les facteurs prédictifs de bon résultat de la SME dans cette indication avaient surtout pointées l’influence de la TcPO2 2-4. Dans la présente étude cette TcPO2 semble peu intervenir à l’inverse du délai « apparition de l’ulcère - début de la SME ».
Bibliographie
1. Ubbink DT, Vermeulen H. Spinal cord stimulation for non-reconstructable chronic critical leg ischaemia. Cochrane database of systematic reviews. 2013;2:CD004001.
2. Gersbach PA, Argitis V, Gardaz JP, von Segesser LK, Haesler E. Late outcome of spinal cord stimulation for unreconstructable and limb-threatening lower limb ischemia. European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery. Jun 2007;33(6):717-724.
3. Ubbink DT, Gersbach PA, Berg P, Amann W, Gamain J. The best TcpO(2) parameters to predict the efficacy of spinal cord stimulation to improve limb salvage in patients with inoperable critical leg ischemia. International angiology : a journal of the International Union of Angiology. Dec 2003;22(4):356-363.
4. Colini Baldeschi G, Carlizza A. Spinal cord stimulation: predictive parameters of outcome in patients suffering from critical lower limb ischemia. A preliminary study. Neuromodulation : journal of the International Neuromodulation Society. Nov-Dec 2011;14(6):530-532; discussion 533.
La technique d'implantation d'une électrode multi-colonne par invasivité minimale (MAST)

La référence
L'article
Du matériel et des techniques chirurgicales minimalement invasives ont été mises au point afin de positionner les électrodes. C’est, notamment, le cas des électrodes percutanées. Néanmoins ces dernières sont réservées à une approche unilatérale de la moelle épinière ce qui peut occasionner des difficultés de positionnement. Une nouvelle génération d’électrodes, dite « multicolonnes » est actuellement utilisée afin d’améliorer les résultats de la stimulation de la moelle épinière (SME) dans certains types de douleurs difficiles à traiter telles que les failed back surgery syndrome (FBSS). Une nouvelle Technique d’Accès Minimal Spinal (MAST) est aujourd’hui en cours d’évaluation afin de mettre en place cette dernière génération d’électrode.
Vingt-quatre patients ont été implantés, avec des électrodes multicolonnes par cette technique MAST pour le traitement de douleurs réfractaires lomboradiculaire. Cette technique a permis un positionnement transligamentaire satisfaisant de ces électrodes tout en minimisant les cicatrices et les lésions musculaires. Aucun effet indésirable lié à technique n’a été déploré ni aucun repositionnement d’électrode nécessaire.
L'utilisation d'une technique MAST pourrait s’avérer utile dans l'implantation des électrodes multicolonnes
Le commentaire
Cette technique présentée par l’équipe de Poitiers est séduisante car, ce système d’écartement tubulaire du site opératoire, présente l’avantage d’une moindre invasivité et a le mérite de standardiser la pose de ce nouveau type d’électrode à seize plots et, ainsi, autoriser des comparaisons entre cohortes. Cette technique est néanmoins plus délicate et sa maitrise implique une courbe d’apprentissage. D’autre part on ne peut négliger le coût supplémentaire — instrument et consommable (fibre optique jetable) — qu’implique cette procédure. Un surcoût dont on ignore s’il peut être compensé par une durée d’hospitalisation plus courte et des suites plus simples.
Dr Marc Lévêque
La stimulation médullaire du cône médullaire dans les névralgies pudendales : une étude prospective de 27 cas consécutifs

La référence
Buffenoir K, Rioult B, Hamel O, Labat JJ, Riant T, Robert R. Spinal cord stimulation of the conus medullaris for refractory pudendal neuralgia: A prospective study of 27 consecutive cases. Neurourol Urodyn. 2013 Nov 19.
L'article
Trente pour cent des patients souffrant de névralgie pudendale par compression du nerf honteux ne sont pas ou peu soulagés par la chirurgie de décompression de ce nerf. L'objectif de cette étude est d’évaluer l'efficacité de la stimulation du cône médullaire chez des patients atteints névralgie pudendale réfractaire.
Une étude prospective a été menée — dans deux centres d’une même ville — visant à décrire les résultats obtenus sur la douleur périnéale et le handicap fonctionnel chez tous les patients implantés au niveau du cône médullaire dans le traitement d’une névralgie pudendale réfractaire. Après discussion multidisciplinaire 27 patients consécutifs ont été inclus entre mai 2011 et juillet 2012. Le suivi moyen était de 15 mois. La mise en place de l’électrode de stimulation était suivie d'une période d'essai — d'une durée moyenne de 13 jours — avant de décider de l'implantation définitive. Les scores EVA de douleur périnéale — moyen et maximum — ainsi que les durées sans douleur ont été comparées lors de la phase d’essai puis à long terme. L'amélioration, en pourcentage, a été évaluée à long terme.
Vingt des 27 patients étaient considérés comme répondeurs à cette stimulation du cône médullaire et 100% des patients implantés demeuraient répondeurs à long terme avec, en moyenne, un triplement du temps assis et une diminution de 55,5 % de l’EVA.
La stimulation du cône médullaire est une technique sûre et efficace dans le traitement à long terme des névralgies réfractaires pudendales. L'utilisation systématique de cette technique, qui n'a jamais été rapportée dans la littérature dans ce type de patient, doit dorénavant être validée par une étude à plus grande échelle.
Le commentaire
Cette belle étude des équipes nantaises vient confirmer les résultats encourageant de deux cas rapportés1,2 dans le traitement par stimulation du cône médullaire de la névralgie pudendale réfractaire. On ne déplore pratiquement aucune complication hormis un déplacement d’électrode et une infection durant la phase test. A noter que la majorité de ces électrodes étaient monocolonnes (18/27) et ont ainsi pu être mises en place sous anesthésie locale avec stimulation peropératoire. Cette confirmation clinique peropératoire n’a pas dispensé les auteurs de réaliser, pour chacun de ces patients, une IRM spinale préopératoire afin de vérifier l’étage vertébral du cône.
Bibliographie
1. Reichart R, Kuhn SA, Vogel I, Walter J, Kalff R. [Spinal cord stimulation at the level of the conus medullaris : treatment option for therapy-resistant postoperative neuralgia of the pudendal nerve]. Schmerz. Dec 2009;23(6):640-644.
2. Rigoard P, Delmotte A, Moles A, et al. Successful treatment of pudendal neuralgia with tricolumn spinal cord stimulation: case report. Neurosurgery. Sep 2012;71(3):E757-762; discussion E763.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
La migration axiale des électrodes de stimulation en fonction de la position

La référence
Kim CH, Green AW, Rodgers DE, Issa MA, Ata MA (2013) Importance of axial migration of spinal cord stimulation trial leads with position. Pain physician 16 (6): 763-768
L'article
La stimulation de la moelle épinière (SME) est aujourd’hui un traitement reconnu de la douleur chronique. Avant l'implantation définitive, des essais temporaires sont réalisés pour évaluer l’efficacité de la SME. Lors de cette période de test, il est fréquent que les patients éprouvent des modifications des paresthésies. Le but de ce travail est d’évaluer la participation de ces changements positionnels dans ces modifications de perception.
Chez les patients dont la phase test est concluante, des radiographies du rachis — en position assise et debout — ont été effectuées après une semaine de stimulation. Ces données d’imagerie ont ensuite été confrontées aux ajustements des paramètres de stimulation faisant suite à ces changements de posture.
Un recul moyen de l’électrode de 3,05 mm a été observé entre les positions debout et assise. La migration moyenne était de 2,85 mm chez les sujets nécessitant un ajustement de la SME en raison du changement de paresthésie, comparé à 3,24 mm chez ceux qui n’en ont pas eu besoin. Les résultats n’établissent pas de lien entre cette migration radiographique lors du changement de position assis à debout et la nécessité de modifier les paramètres (p= 0,17).
Cette étude tendrait à montrer que les modifications de perception lors des changements de position seraient davantage liées à un déplacement de la moelle épinière qu’à une migration de l’électrode.
Le commentaire
Ce travail réalisé par des équipes américaines de Boston et de Ouest-Virginie nous éclaire sur le mécanisme expliquant les modifications de paresthésies en fonction des changements positionnels : cette différence serait davantage liée à un déplacement du cordon médullaire que de l’électrode (Figure 1).
Néanmoins l’effectif réduit de 24 patients nous incite à considérer cette conclusion avec prudence. On regrette également que ce travail n’est pas — en plus de la position débout et assise — cherché à évaluer le décubitus dorsal. En effet, nous savons que la position couchée est très souvent accompagnée d’une exacerbation des paresthésies parfois plus marquée qu’en position assise.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
L'impact des facteurs psychologiques sur les résultats de la stimulation médullaire : une analyse à long terme
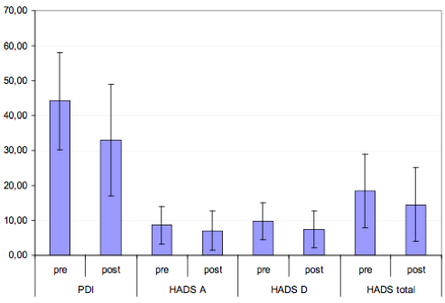
La référence
Wolter T, Fauler I, Kieselbach K. The impact of psychological factors on outcomes for spinal cord stimulation: an analysis with long-term follow-up. Pain physician 2013 ; 16 (3): 265-75.
L'article
Depuis près de trente ans la stimulation de la moelle épinière (SME) est utilisé dans le traitement des douleurs neuropathiques. Les facteurs psychologiques seraient supposées de façon importante à l'efficacité de la SME néanmoins l'impact de ces facteurs n’a été que rarement étudié.
L'objectif de cette étude était de déterminer, par un échantillon clinique représentatif, l'influence de ces facteurs psychologiques tel que l'anxiété et la dépression sur l'issue de la SME. Les dossiers de 60 patients consécutifs qui avaient été traités par SME entre le 1er Juillet 2008 et le 30 Juin 2012. Les informations concernant l'âge, le sexe, le diagnostic, l'âge lors de l'implantation, la durée de la maladie, les scores d’anxiété, de dépression, d'invalidité de la douleur (PDI), les scores de douleur préopératoire sur l’échelle d'évaluation numérique (EN) ont été colligés. En outre, un questionnaire a été envoyé aux participants qui contenaient les éléments suivants : les scores de douleur avec et sans stimulation, les périodes de stimulation, la couverture par les paresthésie, la prise médicamenteuse, la satisfaction apportée par le traitement et des échelles d’auto-évaluations de l'anxiété (HADS-A) et de la dépression (HADS-D, BDI-II et PDI).
Les scores d’anxiété et de dépression préopératoires n’étaient pas significativement différents entre les patients soulagés par la SME et ceux ne l’étant pas. La SME entraine une diminution du score (EN) de douleur ( Tableau I). Les résultats à long terme ne sont pas affectés par les scores d’HADS-A, HADS-D et PDI pré-implantatoires. En revanche les moyennes des scores de dépression et d’anxiété sont abaissées suite à la SME ( Tableau II). Le score d’autosatisfaction est inversement corrélé à celui de l’HADS-A, de l’HAD-S et du BDI-II. Des scores qui sont également
Le résultat du traitement par la SME n'a pu être prédit sur la base des facteurs psychologiques testés (anxiété, dépression et incapacité liée à la douleur). L’indice d’autosatisfaction est inversement corrélée avec l’HADS-D, le BDI-II, et les scores PDI et a montré une tendance à la corrélation avec le pourcentage de réduction de la douleur. Des recherches complémentaires sont nécessaires pour définir l'impact des facteurs psychologiques sur les résultats de la SME
Commentaire
Ce travail, même s’il est grevé de nombreuses faiblesses méthodologiques (étude rétrospective et faible population) aurait tendance à contredire une idée — souvent répandue — qui voudrait que les résultats de la SME soient liés à l’état psychologique pré-implantatoire.
L’autre résultat de cette étude, qui lui est beaucoup moins contre-intuitif, serait que la réduction du score douloureux s’accompagne d’une diminution des scores d’anxiété et de dépression. Preuve, s’il est encore nécessaire de l’apporter, que la dépression et l’anxiété sont bien la conséquence — et non la cause — de l’intensité douloureuse chez ces patients.
Il est, par ailleurs, dommage que les auteurs se soient bornés dans leur analyse des facteurs psychologiques à l’étude des scores de dépression et d’anxiété. On sait, et l’équipe lilloise l’avait déjà très bien démontré il y a maintenant vingt trois ans 1, que d’autres éléments d’ordre psychologique interviennent dans le résultat final : nécessité d’adéquation à une proposition originale, effervescence fantasmatique face à l’accueil de ce matériel étranger actif ou encore l’importance des mise en échec des thérapies précédentes. Bref, l’évaluation psychologique pré-implantation est de rigueur ce que tendrait à infirmer cette étude...
Bibliographie
1. Defontaine Catteau M-C, Blond S, Christiaens J-L. Implantation de stimulateurs à visée antalgique et concomitants psychologiques. Douleur et analgésie. 1990;2:59-62.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
La stimulation médullaire et l'infusion intrathécale : une combinaison de technique de neuromodulation dans les syndromes douloureux régionaux complexes avancés

La référence
Goto S, Taira T, Horisawa S, Yokote A, Sasaki T, Okada Y (2013) Spinal cord stimulation and intrathecal baclofen therapy: combined neuromodulation for treatment of advanced complex regional pain syndrome. Stereotactic and functional neurosurgery 91 (6) : 386-391.
L'article
La stimulation de la moelle épinière (SME) compte parmi les traitements efficaces du syndrome douloureux régional complexe (SDRC). Néanmoins, le soulagement complet de la douleur n’est pas toujours possible et l'effet de la SME tend à diminuer au fil du temps. Récemment le baclofène intrathécale (BIT) s’est avéré être efficace dans la dystonie liée à au SDRC.
Quatre patients (2 hommes, âge moyen : 32,5 ans) avec SRDC réfractaire à un traitement conservateur ont été évalués rétrospectivement. Trois patients ont bénéficié d’une implantation SME première, avec quelques années plus tard, internalisation de pompes à BIT. Chez un patient des bolus de BIT ont été administré durant la période test de SME. L'intensité de la douleur a été évaluée en utilisant l'échelle visuelle analogique (EVA) avant et après l'administration de BIT.
Le soulagement de la douleur de plus de 50 % a été observé chez 1 patient et de plus de 30% chez deux autres. Le taux de réduction de la douleur moyenne parmi les 4 patients était de 28,9 % avant et 43,8 % après le traitement par BIT. Tous les patients — y compris celui n’ayant pas eu d'amélioration de l'EVA — ont montré une diminution des anomalies posturales après l’association de la SME et de la BIT. L’amélioration des anomalies posturales — comme la dystonie ou les mouvements de tremblements paroxystiques — a permis un soulagement général de la douleur tout en réduisant ses fluctuations.
L’association de la SME et de la BIT diminue l'intensité de la douleur, ou améliore anomalies de posture et les mouvements dystoniques associées lors de SDRC réfractaires.
Le commentaire
Ces quatre cas rapportés ont le mérite d’ouvrir une piste de recherche intéressante chez les patients souffrant de SDRC de forme réfractaires, le suivi minimal de 3,5 ans offre un recul satisfaisant. L’effectif faible, le caractère rétrospectif de l’étude et l’absence de groupe contrôle obligent néanmoins a considérer ces résultats avec beaucoup de prudence. Cette étude prolonge des travaux suédois 1-3 ayant montré, ces dernières années, l’intérêt de l’association de la SME et du BIT dans le traitement de douleurs neuropathiques.
Bibliographie
1. Schechtmann G, Lind G, Winter J, Meyerson BA, Linderoth B. Intrathecal clonidine and baclofen enhance the pain-relieving effect of spinal cord stimulation: a comparative placebo-controlled, randomized trial. Neurosurgery. Jul 2010;67(1):173-181.
2. Lind G, Schechtmann G, Winter J, Meyerson BA, Linderoth B. Baclofen-enhanced spinal cord stimulation and intrathecal baclofen alone for neuropathic pain: Long-term outcome of a pilot study. European journal of pain. Jan 2008;12(1):132-136.
3. Lind G, Schechtmann G, Winter J, Linderoth B. Drug-enhanced spinal stimulation for pain: a new strategy. Acta Neurochir Suppl. 2007;97(Pt 1):57-63.
Dr Marc Lévêque
Les complications infectieuses des systèmes de stimulation médullaire et de pompe intrathécale dans un centre anti-cancereux

La référence
Engle MP, Vinh BP, Harun N, Koyyalagunta D. Infectious complications related to intrathecal drug delivery system and spinal cord stimulator system implantations at a comprehensive cancer pain center. Pain Physician. 2013 May-Jun;16 (3):251-7.
L'article
L’administration intrathécale de médicaments (AIM) et les stimulateurs de la moelle épinière (SME) sont des dispositifs implantables pour le traitement de la douleur chronique notamment cancéreuse. Malgré des résultats favorables à long terme ces techniques sont associées à des complications infectieuses dans 2-8 % des cas et nécessite souvent une antibiothérapie prolongée voir le retrait du matériel. Les patients cancéreux sembleraient davantage vulnérables à ce type de complication en raison de leurs immunodépressions liées à la malnutrition et aux chimiothérapies.
Cette étude cherche à déterminer si les patients souffrant de douleurs cancéreuses ont une incidence plus élevée de complications infectieuses suite à l'implantation de systèmes d'AIM ou de SME comparé aux patients non cancéreux.
Une étude rétrospective a été menée sur les données en rapport avec les complications infectieuses des systèmes d'AIM ou de SME implanté au Anderson Cancer Center pour le traitement des douleurs cancéreuses et des douleurs chroniques. Les implants examinés concernaient la période du 15 Juillet 2006 au 14 Juillet 2009. En outre des informations relatives aux comorbidités et aux facteurs de risque périopératoire ont également été recueillies.
Cent quarante-deux dispositifs ont été implantés chez 131 patients au cours de cette période. Quatre-vingt-trois de ces appareils étaient des systèmes d’AIM et 59 de SME. Quatre-vingts pour cent des patients concernés étaient cancéreux. Quatre complications infectieuses ont été observées pour risque infectieux global de 2,8%. Le taux d'infection était de 2,4% pour les systèmes d’AIM contre 3,4% pour les systèmes de SME. Toutes les infections se situaient au niveau du stimulateur ou de la pompe. Le taux d'infection était de 2,7% pour les patients atteints de cancer contre de 3,3% chez non-cancéreux. Ni l'administration périopératoire d'antibiotiques prophylactiques (p=0,4), ni le niveau de risque du Réseau National de Surveillance des Infections Nosocomiales (NNIS) étaient statistiquement associée à des complications infectieuses (p=0,15). Le temps opératoire moyen était significativement plus long pour les cas d'infection à 215±93 minutes contre 132±52 minutes pour ceux sans infection (p=0,02).
L'expérience de cette institution démontre que les complications infectieuses après l'implantation de systèmes d’AIM et de SME demeurent des événements relativement rares. Contrairement à l’hypothèse de départ aucune différence n'a été observée entre le taux d'infection des patients cancéreux et celui non cancéreux. Le principal facteur associé à un risque accru de complications infectieuses est la durée du temps chirurgical.
Le commentaire
La principale limite de cette étude est son caractère rétrospectif. L’autre faiblesse réside dans les 51 patients (38,9%) morts ou perdus de vue dans l’année. Ce biais est de nature à entrainer une sous-estimation des taux d'infection des patients cancéreux et expliqué cette conclusion plutôt contre-intuitive.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
Réduction des aires d'allodynie après stimulation médullaire

La référence
UClin J Pain. 2013 Apr 1. Reduced Areas of Spontaneous Neuropathic Pain After Spinal Cord Stimulation Treatment. Meier K, Jensen TS, Christensen BM, Mølgaard ME, Sørensen JC, Nikolajsen L.
L'article
La stimulation de la moelle épinière (SME) est reconnue comme étant un traitement efficace pour certaines douleurs neuropathiques (DN). Les observations cliniques pourraient avoir tendance à suggérer que l'effet du traitement réside dans une réduction de la superficie du territoire la douleur neuropathique spontanée. Le but de cette étude a été de quantifier la superficie des territoires douloureux chez les patients bénéficiant d’une SME et de les corréler avec les modifications d'intensité de la douleur et de la qualité de vie.
Vingt-six patients atteints de DN sous SME ont évalué l'intensité de leur douleur sur une échelle d'évaluation numérique (0 à 10) et rempli le questionnaire SF-36. En outre, leurs surfaces de DN ont été documentées photographiquement avant et pendant le traitement par SME (Figure 1 ), ces zones ont été quantifiées numériquement.
La surface de DN spontanée a été réduite de 62% (intervalle interquartile, -15 à 78). L'intensité de la douleur a été réduite de 7,5 (± 1,1) à 4,9 (± 1,7). La plupart des domaines du SF-36 ont également été amélioré par la SME. En utilisant une régression linéaire, aucune corrélation n'a été trouvée entre la réduction relative dans les zones de DN spontanée et la réduction relative de l'intensité de la douleur ainsi que dans l'amélioration absolue dans la qualité de vie évaluée par le SF-36. Une corrélation a été trouvée entre la diminution de l'intensité de la douleur et la qualité de vie.
Ces résultats indiquent que l'impact principal de la SME sur la qualité de vie des patients ne réside pas tant dans la réduction des zones douloureuses que dans la réduction de l'intensité de la douleur dans l'espace restant.
Commentaire
Cette étude danoise d’Aharus, qui porte sur un nombre relativement restreint de patients, nous en dis davantage sur la nature du soulagement obtenue par SME : la surface douloureuse est effectivement diminuée mais c’est, avant tout, la réduction d’intensité qui permet ce ressenti de soulagement.
Il est dommage que ce travail, en se concentrant exclusivement sur les douleurs neuropathiques spontanées, n’ait pas cherché à évaluer également les zones d'allodynie ou l'hyperalgésie. Cette critique est a nuancée par le fait que la population étudiée souffrait, majoritairement, de neuropathies diabétiques qui, on le sait, s’expriment principalement par des douleurs sourdes et profondes plutôt que par l'hyperalgésie ou l’allodynie.
Dr Marc Lévêque
La stimulation médullaire dans le traitement des ischémiques des membres inférieurs non revascularisable : une revue systématique

La référence
L'article
Les patients souffrant d'ischémie chronique du membre inférieur et ne pouvant bénéficier d’un geste de revascularisation sont menacés d’amputation. La stimulation de la moelle épinière (SME) est proposée comme une thérapie utile en plus du traitement conservateur standard. Une revue de la littérature a été menée afin d’établir — ou non — des preuves d'une amélioration sur le sauvetage du membre, le soulagement de la douleur et l’état clinique chez les patients porteurs d’une SME comparée à ceux recevant un traitement conservateur seul.
Pour cette méta-analyse Cochrane sur les maladies vasculaires périphériques, un groupe de recherche a évalué la qualité des études présentes dans la littérature scientifique et leurs résultats. Cette évaluation a été menée de manière indépendante par deux experts. Six études (1-6) comprenant un total de près de 450 patients ont été revues. La qualité des études a été jugée bonne. Néanmoins, en raison de la nature de l’intervention, aucun de ces travaux n’était en double-aveugle.
Le sauvetage du membre après 12 mois était significativement plus élevé dans le groupe avec SME (risque relatif [RR] de 0,71, intervalle de confiance à 95 % [IC] 0,56 à 0,90 ; différence de risque [DR] -0.11, IC à 95% -0,20 à -0,02). Une atténuation significative de la douleur était observée dans les deux groupes avec cependant un soulagement significativement plus marqué dans le groupe avec SME dans lequel les patients doivent significativement moins d'antalgiques. Dans le groupe avec SME, beaucoup plus de patients ont atteint le stade de Fontaine II en comparaison avec le groupe conservateur (RR 4,9 ; IC 95% 2,0 à 11,9; RD 0,33; IC 95% de 0,19 à 0,47). Dans les deux groupes aucun effet significativement différent sur la cicatrisation des ulcères n’a été observé. Les complications du traitement par SME consistant en des problèmes d'implantation (9%, IC 95% : 4 à 15 %) et des modifications de la stimulation ayant pu nécessiter une nouvelle intervention dans 15% de ces cas (IC 95% : 10 à 20%). L’infection au niveau du site du neurostimulateur ou de l’électrode est moins fréquente (3 %, IC 95% : 0 à 6%). Le risque global de complication avec un traitement supplémentaire par SME était de 17% (IC 95% : 12 à 22%). Seulement une étude renseignait sur les coûts globaux moyens : à deux ans le coût pour le groupe SME s’élevait à 36500€ contre 28600€ pour le groupe conservateur. Soit une différence de 7900€.Les données de la littérature amènent à favoriser la SME par rapport au traitement conservateur seul.
La SME permet d’augmenter le taux de sauvetage du membre et améliore le soulagement des douleurs. Ces avantages de la SME sont à confronter au surcoût et à des complications possibles mais de faibles gravités.
Le commentaire
Cette méta-analyse 2013 disponible dans la Cochrane Library et qui a également été publiée dans le British Journal of Surgery (7) souligne l’intérêt de la stimulation médullaire dans le traitement de l’artériopathie oblitérante des membres inférieures. Des résultats qui viennent d’être confirmés par une récente étude italienne (8). La stimulation médullaire vient donc renforcer l’arsenal de l’algologue chez les patients ne pouvant être opérés et dont les traitements antalgiques sont insuffisants ou mal tolérés.
Deux réserve néanmoins sur ce travail intéressant : il est étonnant d’y voir figurer l’étude de Spincemaille (2) qui a été arrêtée prématurément de même que celle de Suy (6) qui ne provient pas d’une revue à comité de lecture. D’autre part, il est à noter que l’un des contributeurs de cette analyse critique compte également parmi les auteurs de l’une des études inclus dans cette revue1.
Dr Marc Lévêque
Références bibliographiques
-
Amann W, Berg P, Gersbach P, Gamain J, Raphael JH, Ubbink DT. Spinal cord stimulation in the treatment of non- reconstructable stable critical leg ischaemia: results of the European Peripheral Vascular Disease Outcome Study (SCS-EPOS). European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery. Sep 2003;26(3):280-286.
-
Spincemaille G, Klomp H, Steyerberg E, Habbema J. Spinal cord stimulation in patients with critical limb ischemia: A preliminary evaluation of a multicentre trial. Acta Chirurgica Austriaca. 2000;32(49-51).
-
Claeys LG, Horsch S. Transcutaneous oxygen pressure as predictive parameter for ulcer healing in endstage vascular patients treated with spinal cord stimulation. International angiology : a journal of the International Union of Angiology. Dec 1996;15(4):344-349.
-
Klomp HM, Spincemaille GH, Steyerberg EW, Berger MY, Habbema JD, van Urk H. Design issues of a randomised controlled clinical trial on spinal cord stimulation in critical limb ischaemia. ESES Study Group. European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery. Nov 1995;10(4):478-485.
-
Jivegard LE, Augustinsson LE, Holm J, Risberg B, Ortenwall P. Effects of spinal cord stimulation (SCS) in patients with inoperable severe lower limb ischaemia: a prospective randomised controlled study. European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery. May 1995;9(4):421-425.
-
Suy R, Gybels J, Van Damme H, Martin D, van Maele R, Delaporte C. Spinal cord stimulation for ischemic rest pain. The Belgian randomized study. In: Horsch S, Claeys L, eds. Spinal Cord Stimulation: An innovative method in the treatment of PVD. : Springer; 1994.
-
Ubbink DT, Vermeulen H. Spinal cord stimulation for non-reconstructable chronic critical leg ischaemia. Cochrane database of systematic reviews. 2013;2:CD004001.
-
Tshomba Y, Psacharopulo D, Frezza S, Marone EM, Astore D, Chiesa R. Predictors of Improved Quality of Life and Claudication in Patients Undergoing Spinal Cord Stimulation for Critical Lower Limb Ischemia. Annals of vascular surgery. Dec 13 2013.
La stimulation médullaire à haute fréquence dans le traitement de la lombalgie chronique : les résultats d'une étude prospective clinique européenne

La référence
Van Buyten JP, Al-Kaisy A, Smet I, Palmisani S, Smith T. Neuromodulation. 2012 Nov 23.
L'article
L'objectif de cette étude clinique prospective, ouverte, multicentrique européenne était de d’évaluer l'efficacité et l'innocuité d'une stimulation de la moelle épinière (SME) à haute fréquence (HF), jusqu'à 10 kHz, qui ne produit pas de paresthésie, dans le traitement de la douleur chronique, réfractaire du dos et / ou des membres.
Quatre-vingt-trois patients souffrant de maux de dos importants, ont été recrutés pour un essai de stimulation à HF par deux électrodes épidurales percutanées à huit contacts. Le score de douleur, le handicap, les troubles du sommeil, la satisfaction, ainsi que les taux de complications ont été évalués avec un recul maximal de six mois.
Après une période d'essai, 88% (72 sur 82) des patients ont rapporté une amélioration significative sur l'échelle visuelle analogique (EVA). L’EVA moyenne des lombalgies est passée de 8,4 à 2,7 à six mois (p <0,001) tandis qu’au niveau des membres inférieures elle a été réduite de 5,4 à 1,4 à six mois (p <0,001). Des améliorations significatives dans les scores d’Oswestry, du sommeil ainsi que dans la réduction de l'utilisation des analgésiques. Les effets indésirables observés étaient ceux observés, classiquement, avec la SME conventionnelle à savoir : migration, infection de plaie et douleur au niveau du site d’implantation.
Dans cette cohorte de patients souffrant de lombalgies chroniques difficiles à traiter la stimulation HF permet une diminution durable des douleurs lombaire et un soulagement significatif de la douleur jambe chez plus de 70% des sujets traités. Cette amélioration a été obtenue sans paresthésie. Les patients mentionnent également une réduction significative de l'incapacité et une amélioration du sommeil. Dans l'ensemble, ces résultats confirment un profil de tolérance favorable ainsi qu’une efficacité de la stimulation par HF.
Le commentaire
L’idée de stimuler à très haute fréquence la moelle épinière dans le traitement des lombo-radiculalgies chroniques n’est pas nouvelle. Les auteurs prouvent, par ce travail prospectif bien mené, l’intérêt de cette stimulation HF. L’efficacité sur la douleur apparait comparable à la stimulation « standard », habituellement, aux alentours de 30 à 50 Hz. L’avantage de cette stimulation HF réside, d’une part, dans la possibilité d’augmenter l’intensité de la stimulation sans être limitée par le ressenti douloureux des paresthésies. D’autre part, cela diminue les sensations désagréables perçues lors des changements de positions. Enfin, cette stimulation HF autorise des études en double aveugle impossible autrement.
La principale critique envers cette étude réside dans le peu d’information concernant la consommation électrique. Or, nous savons que, plus la fréquence est élevée plus la durée de vie de la batterie diminue. Cette problématique a été écartée par les auteurs grâce à l’utilisation de stimulateur rechargeable - dont le cout demeure élevé - et l’absence de données relatives à la fréquence de ces rechargements.
La stimulation HF des cordons postérieurs de la moelle demeure une perspective très intéressante dans le traitement des FBSS mais ces investigations nécessiteront, en parallèle, de réelles avancées technologiques dans la capacité des batteries de neurostimulation.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
La stimulation médullaire module la fonction cérébrale : une étude par IRM fonctionnelle
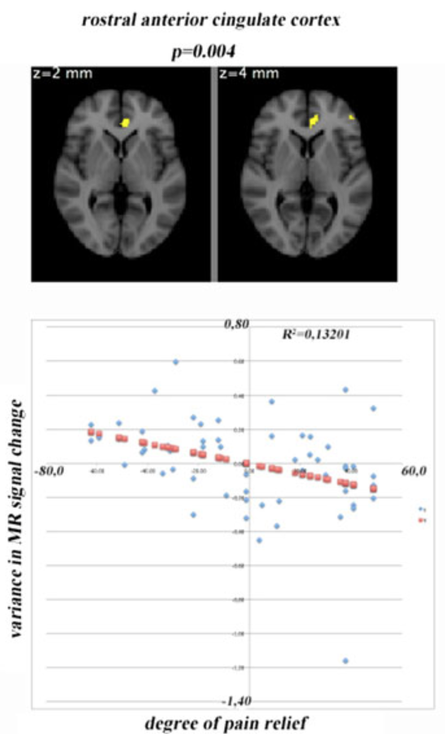
La référence
Spinal cord stimulation modulates cerebral function: an fMRI study. Moens M, Sunaert S, Mariën P, Brouns R, De Smedt A, Droogmans S, Van Schuerbeek P, Peeters R, Poelaert J, Nuttin B. Neuroradiology. 2012 Sep 2.
L'article
Bien que la stimulation de la moelle épinière (SME) soit aujourd’hui largement utilisé dans le traitement de la douleur neuropathique chronique on en sait encore peu sur les mécanismes physiologiques sous-jacents à cette efficacité. Cette étude vise à étudier les mécanismes cérébraux intervenant dans les trente secondes suivant la stimulation au moyen de l'imagerie par résonance magnétique fonctionnelle chez 20 patients traité pour Failed Back Surgery Syndrom (FBSS).
Vingt patients atteints de FBSS, traités par SME externalisés, ont été étudié par IRMf avec des phases de stimulation et de repos de 30 s chacune répétée huit fois de suite. Pendant le cet examen les patients ont évalué l’intensité de la douleur au cours du temps en utilisant une échelle numérique par boutons poussoirs (main gauche, moindre douleur, main droite, plus de douleur).
Une désactivation bilatérale du thalamus dorso-médial a été enregistrée ainsi que de ses connexions avec le cortex cingulaire antérieur et caudale et l'insula. Une corrélation inverse a pu être établie entre un bon soulagement de la douleur et des changements fonctionnels dans le tronc cérébral, le cortex cingulaire antérieur, le cervelet et le cortex préfrontal dorsolatéral bilatéral.
Ces résultats indiquent le rôle clé joué par thalamus dorso-médial en tant que médiateur ainsi que l'implication d'un réseau cortico-cérébelleux impliquant la modulation et la régulation de l'affect hostile et négative liée à la douleur. Selon les auteurs désactivation du thalamus dorso-médial pourrait être utilisé comme un test prédictif à l’efficacité de la SME
Le commentaire
Cette étude montre, une fois encore, combien il est difficile d’interpréter l’activité du cortex cingulaire antérieur dans le traitement de la douleur et de l’analgésie. Cette activité corticale augmente lors d’une stimulation douloureuse 1 tandis la stimulation électrique de ce cortex provoque des sensations douloureuses ou des comportements d’aversion de la douleur 2,3. Curieusement, les traitements opioïdes, les blocs anesthésiques ou la stimulation du cortex moteur entrainent à une activité accrue de ce cortex 4-6 . Dans cette étude belge, avec la SME, nous observons le contraire. Si ces résultats restent d’interprétation difficile, et cela d’autant plus qu’il n’existait pas de groupe témoins dans ce travail, ils viennent confirmer les effets cérébraux de la stimulation médullaire.
bibliographie
1. Peyron R, Laurent B, Garcia-Larrea L. Functional imaging of brain responses to pain. A review and meta-analysis (2000). Neurophysiol Clin. Oct 2000;30(5):263-288.
2. Baliki MN, Chialvo DR, Geha PY, et al. Chronic pain and the emotional brain: specific brain activity associated with spontaneous fluctuations of intensity of chronic back pain. J Neurosci. Nov 22 2006;26(47):12165-12173.
3. Tang J, Ko S, Ding HK, Qiu CS, Calejesan AA, Zhuo M. Pavlovian fear memory induced by activation in the anterior cingulate cortex. Molecular pain. 2005;1:6.
4. Duncan GH, Kupers RC, Marchand S, Villemure JG, Gybels JM, Bushnell MC. Stimulation of human thalamus for pain relief: possible modulatory circuits revealed by positron emission tomography. J Neurophysiol. Dec 1998;80(6):3326-3330.
5. Firestone LL, Gyulai F, Mintun M, Adler LJ, Urso K, Winter PM. Human brain activity response to fentanyl imaged by positron emission tomography. Anesth Analg. Jun 1996;82(6):1247-1251.
6. Garcia-Larrea L, Peyron R, Mertens P, et al. Electrical stimulation of motor cortex for pain control: a combined PET-scan and electrophysiological study. Pain. Nov 1999;83(2):259-273.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
La stimulation médullaire cervicale : une analyse à long-terme de 23 patients

La référence
Wolter T, Kieselbach K. Cervical spinal cord stimulation: an analysis of 23 patients with long-term follow-up. Pain Physician. 2012 May-Jun ; 15(3) : 203-12.
L'article
Depuis plus de trois décennies, la stimulation de la moelle épinière est utilisée pour traiter les douleurs neuropathiques. Malgré son utilisation de plus en plus fréquente au niveau dorso-lombaire, ses résultats à long terme dans les douleurs neuropathiques des membres supérieurs restent peu étudiés.
Le but de cette étude était de déterminer l'efficacité de la stimulation cordonale cervicale (SCC) dans un échantillon représentatif clinique. Les auteurs ont également cherché à étudier les facteurs (paramètres de stimulation, paresthésie du tronc et des jambes, mouvements de la tête) susceptibles d’altérer l’efficacité de la stimulation. L’âge, le sexe, le diagnostic, l'âge au moment de l'implantation, la durée des symptômes douloureux, la position de l’électrode, les révisions, et les paramètres de stimulation ont été colligés. En outre, une entrevue téléphonique a été menée à la recherche des scores de douleur sur l'échelle numérique analogique (ENA) avec et sans stimulation, les intervalles de temps de stimulation, la couverture des douleurs par les paresthésies, les modifications de la couverture des paresthésies suivant les mouvements de tête, la tolérance des paresthésies au niveau du tronc et des jambes, la satisfaction du patient et les prises médicamenteuses.
Sur 23 patients ayant bénéficié d’une implantation d’électrode cervicale (21 percutanées et 2 chirurgicales), 14 ont pu être interviewés. Les douleurs neuropathiques étaient liées à des causalgies, des neuropathies cubitales, des syndromes de Crest, des douleurs de membres fantômes, des cervicobrachialgies post-opératoires et des avulsions plexiques. Les scores moyens de douleur EVA étaient de 6,8 (5,5-10,0 ±1,7) sans stimulation et de 2,8 (0-7,5, ±2.2) avec la neurostimulation (Figure 1). Quatorze révisions (5 en raison d’une dislocation, 5 à cause d’une rupture et 4 révisions de neurostimulateur) ont été nécessaires chez 9 patients au cours d'une durée moyenne de suivi de 6,2 ans. La plupart des patients mentionnaient une couverture complète des douleurs par les paresthésies. Quatre patients ont rapporté des effets indésirables comme des paresthésies du tronc ou des membres inférieurs et 11 patients ont signalé des changements de ces paresthésies lors des mouvements de tête. Dans deux cas, la réduction de la douleur n’était pas affectée.
La stimulation médullaire cervicale semble être efficace dans le traitement de la douleur neuropathique des membres supérieurs. Les complications ne sont pas significativement plus fréquentes que dans SCS des membre inférieur. Les mouvements de la tête ne semblent pas modifier les paresthésies ni affecter le résultat.
Le commentaire
Le principal défaut de cette étude est son caractère rétrospectif ainsi que le nombre important de patients perdus de vue. Cette publication montre l’efficacité de la SCC dans le soulagement des douleurs neuropathiques des membres supérieures, les auteurs pointent la moindre efficacité de la stimulation dans les lésions du plexus brachial avec avulsion des racines nerveuses. On remarque le nombre très élevé de révisions (9 patients sur 14) dans cette série liée, très probablement, à l’utilisation presque exclusive d’électrodes percutanées.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète
La lombalgie : une vraie cible pour la stimulation médullaire ?
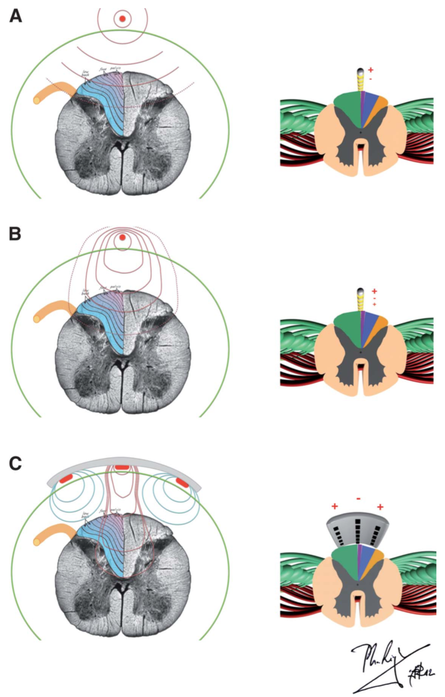
La référence
P. Rigoard, A. Delmotte, S. D'Houtaud, L. Misbert, B. Diallo, A. Roy-Moreau, S. Durand, S. Royoux, J. P. Giot, and B. Bataille. 2012. Back pain: a real target for spinal cord stimulation? Neurosurgery 70:574-584; discussion 584-575.
L'article
Le « Failed Back Surgery Syndrome » (FBSS) est l'une des causes les plus fréquentes de lombalgie chronique et un problème majeur de santé publique. La stimulation médullaire externe (SME) n’est actuellement pas validée dans le traitement des lombalgies en raison des limites techniques du matériel actuel. Aujourd’hui, une nouvelle génération d’électrode permet de couvrir la moelle épinière par des champs électriques longitudinaux et transversaux.
Cette étude vise à évaluer l’efficacité des paresthésies produites par la stimulation multicolonne visant à couvrir les lombalgies des patients souffrant de FBSS réfractaire.
Une électrode tri-colonne à 16 contacts (5-6-5 Medtronic®) a été implantée chez onze patients puis 43 configurations de stimulation ont été testées pour générer des paresthésies bilatérales visant à couvrir les lombalgies en sus du membre inférieur.
Cette électrode, par les paresthésies produites, a permis couvrir, en plus des membres inférieures, le bas du dos chez 9 patients (81,8%). Les taux de réussite, dans la couverture dorsolombaire, de la stimulation multicolonne étaient significativement plus élevés que pour les configurations longitudinales. Six mois après l'implantation, un soulagement significatif a été obtenu par rapport à l'évaluation préopératoire de la douleur globale (échelle visuelle analogique (EVA) : 2,25 vs 8,2 en préopératoire, p= 0.05), des douleurs dans les jambes (EVA : 0,5 vs 7,6 en préopératoire, p=0.05) et des douleurs dorsolombaires (EVA : 1,5 vs 7,8 en préopératoire, p=0.05).
Ces résultats suggèrent les paresthésies produites par stimulation multicolonne peuvent soulager les douleurs dorsolombaires. Ces résultats peuvent amener les cliniciens à considérer de nouvelles indications thérapeutiques dans la stimulation médullaire. Il paraît réaliste, dans un avenir proche, d’élargir les indications de cette SME au FBSS. Même si la SME est aujourd’hui largement utilisée dans le traitement de la douleur neuropathique chronique on ignore encore beaucoup des mécanismes physiologiques qui sous-tendent cette efficacité.
Le commentaire
Cette étude, quoique portant sur une petite série de malades, apparaît très prometteuse pour les patients souffrant de lombalgie et de douleur neuropathique des membres inférieurs.
Ces résultats doivent être confirmés par une importante étude prospective multicentrique (ESTIMET) qui vient d’être lancée en France. Avec la stimulation multicolonne et la stimulation sous-cutanée, les cliniciens disposeront bientôt de nouvelles armes dans le traitement, souvent difficile, des lombodorsalgies rebelles.
Dr Marc Lévêque
Allez sur InfoDouleurNeuroModulation, auquel l'auteur contribue régulièrement, pour une information plus complète


























Cellucci (dimanche, 23 mars 2025 13:14)
L’électrode du stimulateur occipital de mon compagnon vient de traverser sa peau …. Il est actuellement dans un service d’Urgence en attendant la prise en charge de l’établissement où il a été implanté . Aucun changement au niveau de son état général ( bon) et pas de traumatisme . Cet incident ne semble pas décrit !
Carine (lundi, 10 février 2025 20:49)
Bonjour
Faut-il aller en centre de reeducation après la 2eme opération pour apprendre les bons gestes à faire et postures après l'implantation ? Ou un rad suffit avec reprise kine 1 mois post op .
Merci beaucoup
S.B.P (mercredi, 06 novembre 2024 06:10)
Bonjour algodystrophie et allodynie sévère, de la cheville, cette méthode peut telle soulager si aucun traitement médicamenteux ne marche ? Et comment en bénéficier ? Mon centre anti douleurs ne propose pas et me dit qu'il on plus de solution ... Merci
vini (mardi, 01 octobre 2024 12:58)
Bonjour, je suis paraplégique D10/D11 depuis 24 ans, et je souffre depuis de nombreuses années de douleurs atroces diffuses dans tous le corps qu'aucun médicament ne soulage. J'envisage de subir une intervention avec pose d'un neurostimulateur médullaire , mais c'est un vrai parcours du combattant, il me faut trouver moi même un centre de rééducation pour assurer le suivi pendant un mois. Qui peut m'aider ? merci
ANDRE (mercredi, 30 novembre 2022 21:19)
Je souffre du bas de la colonne. Qui serait provoquée par L1 - L2 Jusqu'au bas des pieds je voudrais savoir si ça peut me soulager ses douleurs atroces. Parfois j'ai envie de mettre fin à ma vie. Car beaucoup ne comprennent pas ce que c'est des douleurs atroces. Le jour comme la nuit. Aucun médicament me soulage. Si quelqu'un peut me donner une réponse je le remercie. Car la douleur atroce peut pousser à des suicides
lyne richard 1965 (dimanche, 27 novembre 2022 12:09)
rentrer ds une autre voiture a 90 km a l heure peut etre la cause qu une electrode se deplace de quelques centimetre
une electrode qui envoie son courant directement au foi depuis 3 ans cause des domage au foi......
lyne richard (dimanche, 27 novembre 2022 12:05)
rentrer ds une autre voiture a 90 km a l heure peut etre la cause qu une electrode se deplace de quelques centimetre
Lorans (lundi, 24 octobre 2022 20:59)
Encore en 2017 on m'a posé un stimulateur de douleur est-ce que on le garde à vie où est-ce qu'il va être changé
Arthur LABARRE (Paris) (jeudi, 25 août 2022 18:23)
JE SOUFFRE D'UNE NEUROPATHIE MONSTRUEUSEMENT DOULOUREUSE 24h/4H DEPUIS 8 ANS. J'AI 77 ANS, SUIS AU BORD DU SUICIDE. D'APRES LE PROFESSEUR NADINE ATTAL ET LA FONDAT. ROTHSCHILD Dr. WIART PARIS, IL N'Y AURAIT PLUS "D'ELECTRICITE" ENTRE LE BAS DU DOS ET LE CERVEAU LE LONG DE LA MOELLE. Y A T'IL ENCORE QUELQUE CHOSE A FAIRE ? MERCI. A VOUS LIRE. Arthur LABARRE 31 RUE ROBERT DE FLERS 75015 PARIS. TEL. : 0698757883. E-mail : arbef@orange.fr
regis (dimanche, 07 août 2022 15:13)
bonjour actuellement je suis avec un appareil tens transcutané voir si cela fonctionne par la suite si cela marche sa voudrais dire que on va me proposé un medulaire ?
douleur depuis plus de 2années post operatoire arthrodése l4L5 et pth droite douleur en continue merci de votre réponse
Cadot nicole (mardi, 12 avril 2022)
Bonjour, est-ce possible et où consulter à partir de Grenoble ? Sachant que je suis sujet à une discopathie dégénérative, rétrécissement canalaire, scoliose lombaire, arthrose . Douleurs permanentes , je ne supporte plus les médicaments. Quelle solution pouvez-vous m’apporter ? Merci
Alex (lundi, 21 mars 2022 10:44)
Bonjour, sachant que les douleurs neuropathiques rebelles sont causées par un manque de molécule ubiquitine ligase need4-2, la simulation médullaire change t-elle quelque chose du côté moléculaire ou ne fait elle que masquee la douleur ?
DEBOUT VÉRONIQUE (mardi, 01 février 2022 09:12)
Peut on enlever les électrodes après plusieurs années d'implantation
Amandine (vendredi, 28 janvier 2022 10:24)
Bonjour, Je souffre de douleurs neuropathiques (cervicales) depuis plus de 4 ans (déclenchées essentiellement par la marche). Je suis sur Clermont-Ferrand, connaissez-vous un spécialiste qui pourrait me recevoir ? Merci
Quiterio (lundi, 17 janvier 2022)
Bonjour, j’habite sur Vichy. Quels sont les neurochirurgiens qui implantent un neuro stimulateur sur Clermont-Ferrand Saint Étienne ou Lyon? Je vous remercie.
Etchebarne Martine (vendredi, 07 janvier 2022 12:07)
Bonjour ,je souffre de douleurs chroniques en position assise.j'ai fait une chute dans un escalier il y a au moins 20 ans;depuis je souffre d'un pincement dès que je suis assise et plus je reste assise plus j'ai mal et la douleur se transforme en brûlure,c,est un gros handicap dans la vie de ne pas pouvoir s'assoir!
j'ai eu des infiltrations sous scanner dont une m'avait donner la sensation de moins sentir le pincement en position assise.
On ne voit rien dans les Irm .
J'ai eu une intervention chirurgicale ,pour enlever un muscle fessier nécrosé qui pouvait provoquer la douleur,mais pas de résultat.
j'ai eu une autre intervention chirurgicale pour libérer le nerf cruédale et pudendale qui est dans la zone où j'ai cette douleur,mais je n'ai pas eu le résultat esconté!
Mon foie ne supporte aucun médicament comme le paracetamole,tramadole,kétophène,morphine....
je souhaiterai savoir vers quel neurologue qui pratique la pose de stimulateur médullaire je peux prendre contact,je suis domiciliée dans les Pyrénées Atlantiques
merci et mes meilleurs voeux ;
bresson Josette (dimanche, 19 septembre 2021 13:59)
Implantée d'un stimulateur médullaire Medtronic Prime Advanced 37702 électrodes chirurgicales 565, malheureusement inefficace, pourrais-je passer une IRM une fois la pile à la fesse retirée
mariefrance joveniaux (vendredi, 30 juillet 2021 10:22)
est ce que je peux pretendre a la stimulation medullaire pour des brulures type neurophatie dans les seins merci de votre reponse .installe depuis 3 ans
Annie Pélissier (jeudi, 06 mai 2021 05:35)
J'ai des calculs rénaux de plus de 10 mm, quelle technique pour les exploser sans endommager mon neurostimulateur médullaire ?
Lepretre (vendredi, 23 avril 2021 14:10)
Bonjour
Moi j'ai été implanté le 1er mars
Ma question ❓
J'ai était sportif je fesait du vélo, et du trail,
Et j'étais magasinier
Ma réponse ?
Est-ce que je pourrais continuer
Merci
laurent.legrand@equipement.gouv.fr (jeudi, 18 février 2021 19:44)
bonjour , ma fille suite a un grave accident de la circulation, doit se faire poser un boitier pour lutter contre de fortes douleurs neuropathiques. Elle attend l operation depuis debut 2019 et la date d intervention est toujours repoussée(en raison du covid mais pas seulement) a l hopital huriez de lille (centre de la douleur du professeur wattiez). nous cherchons un praticien en haut de france ou en region parisienne capable de faire cette intervention . avez vous un contact a nous donner? bien cordialement
Chloé (mardi, 09 février 2021 17:40)
Est la stimulation médullaire est possible à 16 ans?
Marie D (dimanche, 31 janvier 2021 12:49)
On me dit que certains gestes seront proscrits pour éviter l'arrachement ou migration d'une électrode quels sont les gestes proscrits peut on bouger la colonne vertébrale normalement? se baiser normalement amener les genoux au menton.....enfin des gestes usuels de souplesse.... avoir encore des massages par le kiné.... des étirements soulever un peu de poids faire un peu de sport musculation....juste de façon raisonnable pour bouger.....peut on également dormir dans n'importe quelle position dorsale ventrale latérale.Merci d'avance
faidy@bbox.fr (lundi, 16 novembre 2020 11:47)
une trés grosse inquiétude
Et besoin d'une réponse
dois je envisager une reconversion ?
cordialement
Christophe (mardi, 27 octobre 2020 00:26)
Bonjour apres cette opération es ce qu on le perd le sommeil car c'est se qu'il m arrive et les nuit sont tres longues merci de votre réponse
Vasseur Marie claude (mercredi, 21 octobre 2020 09:38)
Je viens de voir une chronique sur la deuxième chaîne qui vantait votre stimulateur pour là douleur. J,ai 71 ans avec des problèmes de dos qui augmente cette dernière année le confinement m,a fait beaucoup de mal. J,allait marcher je faisait du pilate bien sur j,avais mal mais on s,habitué à là douleurs ces derniers mois j,ai beaucoup de mal à marcher j,ai l,impression que mon dos ne me porte plus je ne me laisse pourtant pas aller j,ai même acheter un tapis de marche J,ai un problème d ypér tention j,ai eut un infactus il y a presque 6 ans je suis très bien suivis J,ai travaillé avec des personnes âges en epad et je me suis fait mal au dos je ne peut pas prendre d,anti inflammatoire et très peut d,anti douleur si je pouvais profiter de votre boîtier ça me changerais certainement la vie. Merci à l,avance
Martinez (jeudi, 01 octobre 2020 17:47)
Bonjour
Es ce que je vais pouvoir remonter a cheval après mon implantation svp
Merci
BESSE (mardi, 25 août 2020 13:44)
Bonjour
Est-ce qu on peut poser ce procès sur les cervicales. vers quel établissement se tourner ?
Cordialement
Chamoulaud (jeudi, 30 juillet 2020 17:20)
Peut-on continuer à conduire un chariot élévateur avec un neurostimulateur médullaire
bourdet (mardi, 14 juillet 2020 16:42)
bonjour
mon conjoint dois se faire opérer le mois prochain d'un stimulateur.
il a des douleurs permanente au niveau de la hanche car il a un muscle accessoire qui comprime le nerf sciatique et l'artère fémoral ceux qui engendre d'autres problème épine calcanéenne au deux talons mauvaise posture... l'implant l'aidera t il?
merci de votre réponse
Mathellie (jeudi, 09 juillet 2020 09:08)
Pourrais je pratiquer le ski avec prudence cet hiver implantation 6 juillet?
Amandine (29 Mai 2020) (vendredi, 29 mai 2020 22:18)
Peut-on guerrie une paresy du bras grace au stimulation médullaire ???
Rosenthal (samedi, 09 mai 2020 12:09)
Est-ce que l'âge du patient peut être une contradiction ?
Jean (samedi, 18 avril 2020 18:01)
Y a-t-il un risque ou inconvénient à l'utilisation de plaques de cuissons à induction lorsqu'on est porteur d'un stimulateur médullaire ?
Pernice vanessa (jeudi, 19 mars 2020 15:25)
Bonjour, je me suis faite implanté une stimulation medullaire le 19 Fevrier 2020 dû a une sciatique neuropathie.
J'ai des douleurs assez régulières au niveau de la pile es ce due à la cicatrisation ?
Combien de temps il faut pour reprendre une activité sportive comme vélo intérieure ou piscine..
Merci par avance.